2026年2月16日
理化学研究所
高輝度光科学研究センター
東北大学
京都大学
タンパク質の動きを捉える新しい試料導入システムを開発
-テープ搬送による試料導入で試料消費量を低減-
理化学研究所(理研)放射光科学研究センター ビームライン開発チームの姜 正敏 研究員、同SACLAビームライン基盤グループの矢橋 牧名 グループディレクター、高輝度光科学研究センター XFEL利用研究推進室の登野 健介 チームリーダー、東北大学 多元物質科学研究所の南後 恵理子 教授、京都大学 大学院医学研究科の岩田 想 教授らの国際共同研究グループは、X線自由電子レーザー(XFEL)施設「SACLA[1]」において、タンパク質の動きを捉える連続フェムト秒結晶構造解析(SFX)[2]のための試料を導入する新たなシステムを開発しました。
本研究成果により、わずかな量の試料で時分割の構造解析が可能となり、タンパク質の動きが原子レベルで明らかになることが期待されます。
生体の重要な構成成分であるタンパク質が機能する際、巧妙にその構造を変えて機能を発揮していることが知られています。その動きを動画のように可視化する技術として、XFELを用いた時分割連続フェムト秒結晶構造解析(時分割SFX)[2]が利用されてきました。
今回、国際共同研究グループは、SACLAにおいて、結晶を含んだ微小液滴をテープの上に滴下し、ベルトコンベアのようにX線レーザーの照射領域に運ぶ手法を開発しました。結晶を含んだ微小液滴に反応分子などを含む別の微小液滴を重ねて滴下することにより、タンパク質が反応する過程を追跡する実験も可能となりました。
本研究は、科学雑誌『Journal of Applied Crystallography』(2月8日付)に掲載されました。
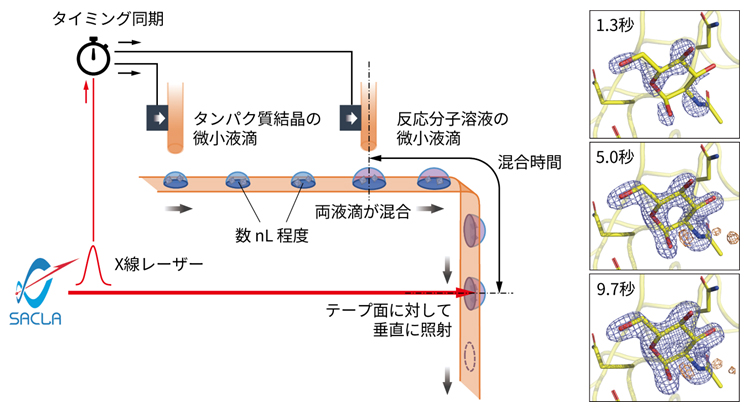
テープ搬送による試料導入システムでタンパク質の動的構造解析をわずかな試料で実現
背景
ヒトの体の重要な構成成分であるタンパク質は、複雑に折り畳まれた構造を取っています。その立体構造と機能は深く関連しており、タンパク質が機能を発揮する際には巧みに構造を変えることが知られています。この動的な構造変化を原子レベルで解明することは、生命現象の理解や薬剤設計の上でも重要です。しかし、従来の方法ではタンパク質分子が素早く変化する過程を原子レベルで可視化することは困難でした。
X線自由電子レーザー(XFEL)を用いた「連続フェムト秒結晶構造解析(SFX)」は、この動的構造の解明に大きな進展をもたらしました。SFXは、フェムト秒(1,000兆分の1秒)単位の極めて短い発光時間を持つX線レーザーをタンパク質の微小結晶に照射し、生体温度に近い条件で立体構造データを取得する手法です。特に「時分割連続フェムト秒結晶構造解析(時分割SFX)」は、光、熱などの物理的刺激や、基質[3]、リガンド(配位子)[4]などの分子との結合によってタンパク質との反応が開始する時間を変えながら測定が可能であり、構造変化をリアルタイムに捉える唯一の手法として用いられてきました。
XFELを用いた実験では、高強度のX線レーザーによる照射後に試料が崩壊するため、新たな試料を次々と導入する必要があります。従来のSFX実験では、微小結晶を液体に混合してX線レーザーによる照射位置まで連続的に流す方法が使われてきました。しかし、X線レーザーは連続的に試料に照射されるのではなく、例えば1秒間に数十回程度の繰り返しで間欠的に照射されます。X線レーザーが照射されていない間も試料は流れ続けるため、その大部分がX線レーザー照射の実験に用いられず浪費されていました。タンパク質試料の調製には多大な時間とコストを要するため、この浪費を最小限に抑えることは重要な課題となっています。
研究手法と成果
タンパク質試料の浪費といった課題を解決するため、先行研究ではテープをコンベアベルトとして利用し、その上に滴下した液滴をX線レーザー照射位置まで運ぶ方法が提案されていました。国際共同研究グループは、この手法をさらに発展させ、よりコンパクトで実用性の高い試料導入システムを開発しました(図1)。
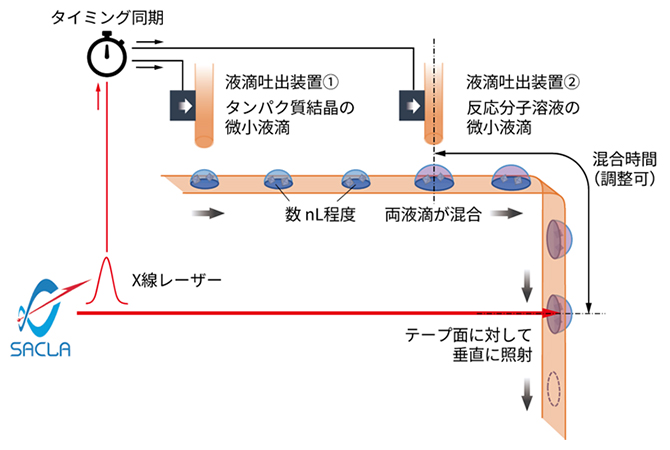
図1 テープ搬送による試料導入システムの概念図
ナノリットルスケールの微小液滴を高速に吐出する装置を2台、テープ送り方向に沿って配置し、結晶を含む微小液滴と反応分子溶液の微小液滴をテープ面上に重ねて吐出する。X線レーザーの照射位置までベルトコンベアのように運び、液滴が載ったテープ面に対して垂直にX線を照射してデータを取得する。X線レーザーパルスの照射タイミングに合わせて液滴を供給し、試料の浪費を抑える。
このシステムでは、ナノリットル(nL、1nLは10億分の1リットル)スケールの微小液滴を高速に吐出(としゅつ)する装置を2台、テープ送り方向に沿って直列に配置しました。テープは、耐久性などに優れた、厚さ約12マイクロメートル(μm、1μmは100万分の1メートル)のポリイミドフィルムを採用しました。それぞれの液滴吐出装置から、結晶を含む微小液滴と反応分子溶液の微小液滴をテープ面上に連続的に重ねて吐出します。その後、ベルトコンベアのようにX線レーザーの照射位置まで液滴を運び、液滴が載ったテープの裏面から垂直にX線レーザーを照射してデータを取得します。テープ面をX線に垂直に配置したことで、X線の焦点とテープ面上の液滴との位置合わせが飛躍的に簡便になり、測定の安定性が向上しました。また、液滴の吐出タイミングを、間欠的なX線レーザーの照射と同期させることで、高効率にデータを収集することができます。さらに、テープ送り速度や反応開始地点からX線照射位置までの距離を調整することで、約0.1秒から20秒弱までの範囲で、二つの微小液滴の混合時間を制御できるようにしました。
本システムの性能を実証するため、X線自由電子レーザー施設「SACLA」において、二液混合型の時分割SFX実験を実施しました。モデルタンパク質試料として、酵素であるニワトリ卵白由来のリゾチーム[5]の結晶と、その阻害剤であるN-アセチルグルコサミン[6]を使用しました。実験では、リゾチーム結晶を含む微小液滴と、N-アセチルグルコサミン溶液の微小液滴がテープ面上で重なった時からX線レーザーが照射されるまでの時間を数点設定し、反応過程における活性部位の変化を追跡しました。
この実験により、混合から一定時間経過後に、基質がリゾチームの活性部位に結合していく過程を原子レベルで捉えることに成功しました(図2)。さらに、各時点のデータセットを取得するために必要なリゾチームの消費量をわずか1~2mgに抑えることができました。これは、従来の実験方法に比べて、数十~数百分の1に当たる量となります。本システムでは、可視光レーザーを導入することで光励起型の時分割SFX実験も可能であり、これまで以上に多様なタンパク質に対して時分割SFX実験を適用することができます。
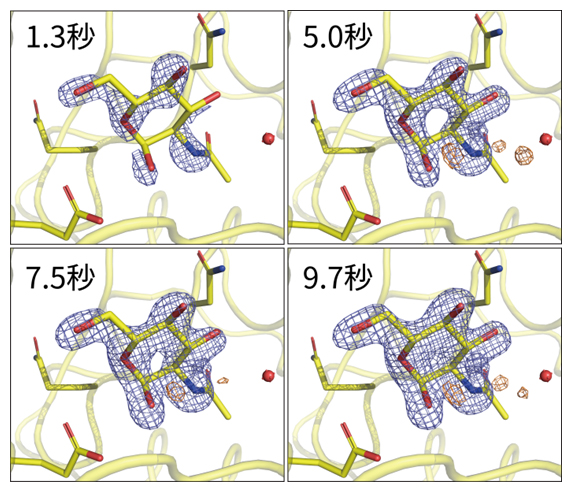
図2 リゾチームの反応過程における活性部位の変化
一定時間経過後に、基質がリゾチームの活性部位に結合していく過程の原子レベルでの立体構造。各図中の左上は、リゾチーム結晶を含む微小液滴に反応分子溶液を滴下した後の経過時間。青色のメッシュは電子密度で、活性部位の変化を示している。メッシュ内スティックモデルの黄色は炭素原子、青色は窒素原子、赤色は酸素原子を示す。
今後の期待
今回開発したシステムは、従来SFXで用いられてきた連続的な試料導入方法とは異なり、XFELを用いたX線レーザーの照射に同期した試料導入により試料消費量を削減するとともに、安定して高品質なデータを取得することを可能にしました。また、従来の方法に比べ、反応開始後から数十秒といった遅い反応を捉えることもできます。本技術の普及により、酵素などにおける反応過程の解明や、薬剤が標的タンパク質に結合する詳細なプロセスの可視化が加速されることが期待されます。
補足説明
- 1.SACLA
理研と高輝度光科学研究センター(JASRI)が共同で建設した日本初のX線自由電子レーザー(XFEL:X-ray Free-Electron Laser)施設。加速器の中で電子の固まりを正確な制御の下で一斉に振動させ、その電子の固まりからX線レーザーを発生させるX線発生装置。2006年度から5年間の計画で建設・整備を進めた国家基幹技術の一つで2011年3月に完成し、SPring-8 Angstrom Compact free-electron LAserの頭文字を取ってSACLA(サクラ)と命名された。2011年6月に最初のX線レーザーを発振、2012年3月から供用運転が開始され、利用実験が始まった。大きさが諸外国の同様の施設と比べて数分の1と、コンパクトであるにもかかわらず、0.1ナノメートル以下という世界最短波長クラスのレーザーの生成能力を有している。詳細はSACLAのウェブサイトを参照。 - 2.連続フェムト秒結晶構造解析(SFX)、時分割連続フェムト秒結晶構造解析(時分割SFX)
連続フェムト秒結晶構造解析(SFX)は、多数の微小結晶を含む液体などをインジェクターと呼ばれる装置から連続的に導入し、フェムト秒のX線レーザーパルスを照射して結晶構造を解析する手法。配向(配列方向)の異なる多数の微小結晶からの回折データを連続的に収集する。さらに、光照射(光励起型)、温度上昇、基質([3]参照)混合(二液混合型)などで反応が開始する時間を変えながら測定することで、タンパク質の構造変化をフェムト秒~秒スケールで連続追跡し、反応過程を"動画"のように可視化できる手法を時分割SFXという。SFXは、Serial Femtosecond Crystallographyの略。 - 3.基質
酵素反応によって消費される化学物質のこと。例えば、酒類に含まれるエタノールはアルコール分解酵素の基質である。 - 4.リガンド(配位子)
受容体や酵素などの標的タンパク質に結合し、その働きを「スイッチ」のように調節する分子。医薬品候補の多くはリガンドとして作用し、病気に関わる反応を選択的に制御する。構造解析によりタンパク質とリガンドの結合様式を可視化できる。 - 5.リゾチーム
多糖類を加水分解する酵素の一つ。本研究で用いたニワトリ卵白リゾチームは129個のアミノ酸残基により構成されており、2個のメチオニン、および8個のシステインを含む。タンパク質のX線結晶構造解析において、リゾチームはモデルタンパク質としてよく用いられる。 - 6.N-アセチルグルコサミン
アセチル化した2-アミノグルコースで糖の一種。細菌の細胞壁(ペプチドグリカン)や真菌のキチン、糖タンパク質の糖鎖の構成要素として広く存在する。生体分子の安定化や認識、シグナル伝達に関与する。
国際共同研究グループ
理化学研究所 放射光科学研究センター
ビームライン開発チーム
研究員 姜 正敏(カン・ジョンミン)
SACLAビームライン基盤グループ
グループディレクター 矢橋 牧名(ヤバシ・マキナ)
高輝度光科学研究センター XFEL利用研究推進室
チームリーダー 登野 健介(トノ・ケンスケ)
東北大学 多元物質科学研究所
教授 南後 恵理子(ナンゴ・エリコ)
(理研 SACLA利用技術開拓グループ(研究当時)チームリーダー(研究当時))
京都大学 大学院医学研究科
教授 岩田 想(イワタ・ソウ)
(理研 SACLA利用技術開拓グループ(研究当時)グループディレクター(研究当時))
Diamond Light Source UK XFEL Hub(英国)
グループリーダー アレン・オルベイル(Allen M. Orville)
研究支援
原論文情報
- Jungmin Kang, Yoshiaki Shimazu, Fangjia Luo, Ayumi Yamashita, Tomoyuki Tanaka, Yuichi Inubushi, Kensuke Tono, Nipawan Nuemket, Allen M. Orville, So Iwata, Eriko Nango, and Makina Yabashi, "Compact Tape-Driven Sample Delivery System for Serial Femtosecond Crystallography", Journal of Applied Crystallography, 10.1107/S1600576726000063
発表者
理化学研究所 放射光科学研究センター
ビームライン開発チーム
研究員 姜 正敏(カン・ジョンミン)
SACLAビームライン基盤グループ
グループディレクター 矢橋 牧名(ヤバシ・マキナ)
高輝度光科学研究センター XFEL利用研究推進室
チームリーダー 登野 健介(トノ・ケンスケ)
東北大学 多元物質科学研究所
教授 南後 恵理子(ナンゴ・エリコ)
京都大学 大学院医学研究科
教授 岩田 想(イワタ・ソウ)
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
公益財団法人高輝度光科学研究センター(JASRI)利用推進部 普及情報課
Tel: 0791-58-2785
Email: kouhou@spring8.or.jp
東北大学 多元物質科学研究所 広報情報室
Tel: 022-217-5198
Email: press.tagen@grp.tohoku.ac.jp
京都大学 広報室 国際広報班
Tel: 075-753-5729
Email: comms@mail2.adm.kyoto-u.ac.jp
