理化学研究所(理研)生命機能科学研究センター 構成的細胞生物学研究チーム(研究当時)の山本 啓 基礎科学特別研究員(研究当時)、宮﨑 牧人 チームリーダー(研究当時、現生命医科学研究センター 構成的細胞生物学研究チーム チームディレクター)の研究チームは、細胞骨格[1]を構成するアクチン分子[1]を素材とした3次元構造を自在につくることができる3Dプリンターともいえる新技術を開発しました。
本研究成果は、細胞の変形を伴う移動(遊走)や分裂など、アクチンが担う基本的な生命機能の理解とともに、生体親和性の高い分子ロボットのデザインへの応用にも貢献すると期待されます。
動物細胞の形態は、アクチン分子が繊維化してできた網目状のネットワークと、アクチンに結合するさまざまなタンパク質との相互作用によって調節されています。これまでに多くのアクチン結合タンパク質の機能が明らかにされてきましたが、アクチンネットワークの「密度」がアクチン結合タンパク質の機能をどのように制御するのかは明らかではありませんでした。今回、研究チームは、アクチンネットワークの密度や3次元的な形を人工脂質膜上で自在に光操作する技術を開発しました。この技術を応用し、アクチン結合タンパク質のネットワークへの入り込みやすさや機能が、アクチンの密度依存的に変化することを示しました。
本研究は、科学雑誌『Nature Communications』オンライン版(8月26日付)に掲載されました。
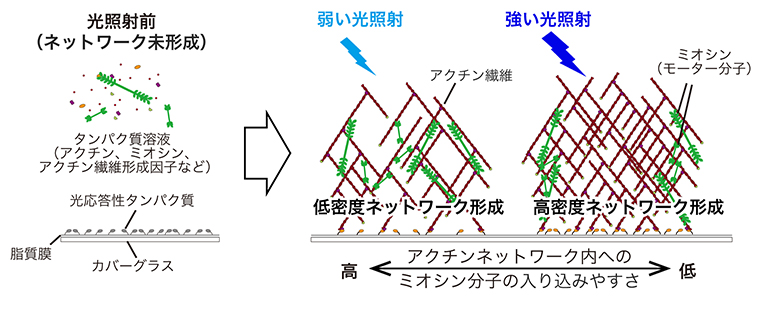
アクチンネットワークの「密度」で制御されるアクチン結合タンパク質の機能
背景
私たちの体を構成する細胞は、常に形を変えながら動き回ったり、くびれて分裂したりするなど、形態の変化が重要な機能を果たしています。この原動力となるのが、細胞膜を裏打ちするタンパク質として知られるアクチンから成る細胞骨格です(図1)。一つ一つのアクチン分子は球状ですが、重合すると繊維状の構造を形成し、最終的に網目状のネットワークが組み上がります。さらに、細胞内ではさまざまな「アクチン結合タンパク質」がネットワークを足場としてアクチンと結合したり、離れたりすることで、状況に応じた柔軟な細胞の変形が可能となります。
これまでの研究から、アクチン繊維を形成するNPF[2]、張力を生成するミオシン[3]、アクチン繊維を分解するコフィリン[4]など、アクチン結合タンパク質は種類ごとに多様な機能を持ち、それぞれ数nmから数百nm(1nmは100万分の1ミリメートル)までの特徴的なサイズを持つことが明らかになってきました。興味深いことに、アクチンネットワークの持つ網目の穴の大きさも数十nm程度と報告されています。このことは、アクチンネットワークがタンパク質サイズのフィルターとして働くことで、細胞の変形や機能を調節できる可能性を示唆しています。今回研究チームは、こうしたアクチンネットワークの密度が果たす役割を解明するための新たな実験技術を開発しました。
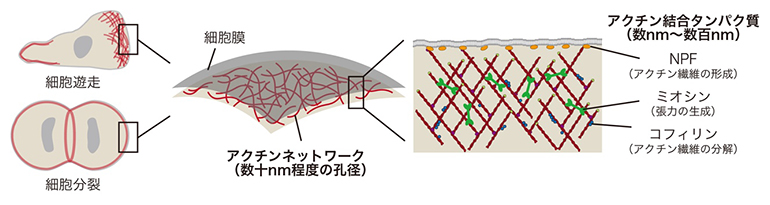
図1 アクチン細胞骨格による細胞機能の制御
細胞は、移動(遊走)や分裂の際に特徴的な形を取る。細胞膜の直下には、網目状のアクチンネットワークが張り巡らされており、アクチン結合タンパク質の足場を提供する。アクチン結合タンパク質には種類ごとにアクチン繊維の形成(NPF)、張力の生成(ミオシン)、アクチン繊維の分解(コフィリン)などさまざまな機能があり、アクチンとの相互作用を通じてネットワークの性質を変化させる。
研究手法と成果
本研究では、アクチンネットワークの形成に必要なタンパク質を精製し、試験管内で混合、再構成することで、ネットワークの密度が果たす役割を直接的に明らかにしようとしました。生きた細胞内でのアクチンネットワークの密度は、細胞膜上に存在するNPFの密度によって調節されます。そこで研究チームは、細胞膜を模倣した人工脂質膜上へのNPFの集積量を操作できれば、アクチンネットワークの密度変化による影響を定量的に調べられるだろうと考えました。そこで着目したのが光遺伝学[5]の技術です。光遺伝学を利用することで、脂質膜上へのNPFの集積だけでなく、その集積量を光照射の強さによって制御することができます(図2A)。試行錯誤の結果、照射する光の強度を微弱な範囲内で変化させることで、異なる密度のネットワークを同一脂質膜上で形成させることに成功しました(図2B、C)。
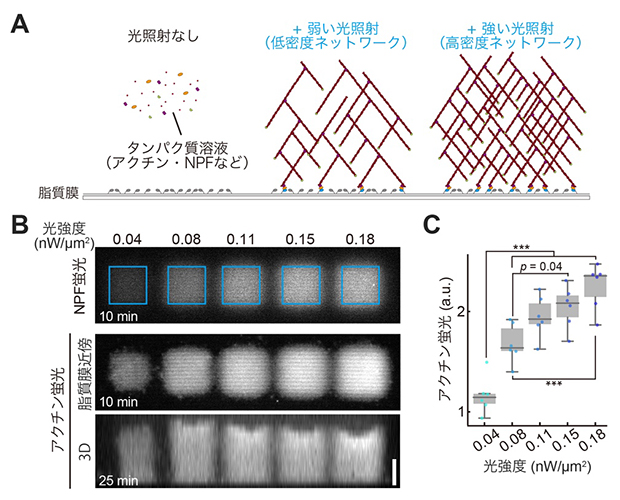
図2 光照射によるアクチンネットワークの構築
- (A)光照射によるアクチンネットワーク構築の仕組み。カバーグラス上に形成した人工脂質膜に光照射をすると、アクチン重合に必要なNPF分子(黄色)が脂質膜上に集積する仕組みを持たせた。光照射前はネットワーク形成に必要なタンパク質は溶液中を拡散しているが(左)、脂質膜上に張り付けた光応答性のタンパク質(青色)が光照射により活性化し、NPFが人工脂質膜上に集積すると、アクチンネットワークの形成が始まる(中・右)。ネットワークの密度は、集積するNPF分子の数(=光照射の強さ)によって決まる。
- (B)光強度によるNPF(上)およびネットワーク密度の制御(中・下)。蛍光標識したNPFおよびアクチンを用い、人工脂質膜に光照射を一定時間行った後に蛍光顕微鏡で観察した。光が強いほどNPFの集積量が増え(上)、膜近傍のアクチン量も増加する(中)。重合したアクチンは膜から上方向へ柱状に成長していく(3D図の下側が脂質膜)。スケールバーは20マイクロメートル(μm、1μmは1,000分の1ミリメートル)。
- (C)光強度ごとのアクチンネットワーク密度の定量。10分間の光照射後のアクチンの蛍光の強さを比較したもの。a.u.:任意単位(arbitrary unit)。「***」有意水準0.1%での有意差ありを示す。
次に研究チームは、アクチンネットワークの密度と代表的なアクチン結合タンパク質との関係性を調べました。まず選んだのが、細胞内で張力を生み出すアクチン結合タンパク質であるミオシンです。ミオシンは比較的大きなフィラメント(繊維)を形成することが知られています(本論文で用いたミオシンフィラメントの長さは平均で約1.3μm)。興味深いことに、さまざまな密度のアクチンネットワークとミオシンを共存させた結果、わずか数倍のネットワーク密度の増加により、アクチンネットワークへのミオシンの入り込みが厳密に妨げられることが明らかになりました(図3A、B)。さらに、密度の勾配を持つ薄いシート状のアクチンネットワークを形成させることで、ミオシンを原動力としたアクチンネットワークの移動が人工脂質膜上で起きることも分かりました(図3C)。こうした現象は、細胞が分裂する際の「くびれ」の形成の直前に細胞膜を裏打ちするアクチンネットワーク内で起きていることが報告されています。本研究の結果は、こうした生きた細胞内で見られるアクチンネットワークの移動の方向性が、その密度の勾配によって決定付けられることを示唆しています。
次に選んだのは、アクチン繊維を分解する機能を持つコフィリンです。コフィリンは比較的小さいアクチン結合タンパク質として知られており(直径は約3.5nm)、これと一致するように、ネットワーク密度を問わずコフィリンはネットワーク内部に入り込めることが分かりました(図3D、E)。一方で、アクチン繊維の分解が高密度のネットワークにおいて顕著に抑制されることも発見しました(図3F)。これらの結果は、ネットワークの密度に応じたコフィリンの新たな性質を示唆しています。
一連の実験を通じて、研究チームは、アクチンネットワークの密度がアクチン結合タンパク質の入り込みやすさだけでなく、その機能まで調節し得ることを示しました。今回の再構成実験で見いだされたネットワーク密度によるタンパク質機能の調節は、アクチン細胞骨格の新たな役割といえます。
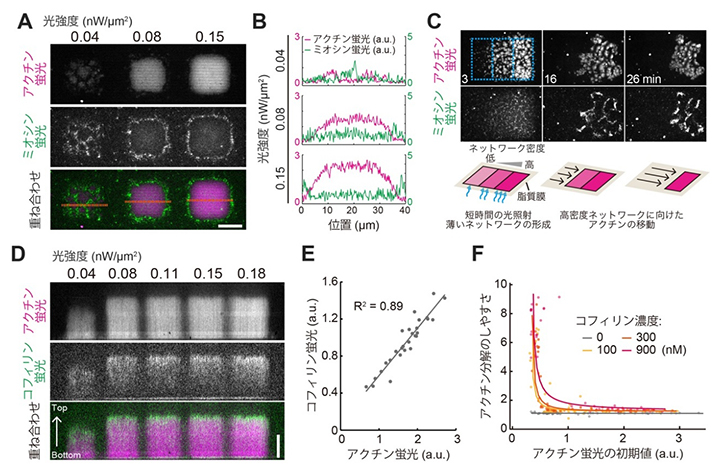
図3 アクチン結合タンパク質とアクチンネットワークの混合実験
- (A)ネットワーク密度に依存したミオシンの排除。ネットワーク密度の高い(=光照射の強い)条件ではミオシンがアクチン内部に入り込めない。
- (B)(A)のオレンジ線に沿って、アクチンとミオシンの蛍光強度を定量したグラフ。光強度0.04ではアクチンとミオシンの分布が全体的に重なっているが、ネットワーク密度が増加するとアクチンが集積した領域との境界にミオシンが分布するようになる。
- (C)ネットワークの密度勾配によって起きたアクチンの運動。アクチンは密度の高いネットワーク(写真の右方向)に向かって移動する。
- (D)密度に依存しないコフィリンのネットワークへの浸透。
- (E)ネットワーク内部のアクチンとコフィリンの蛍光輝度値の相関を示す散布図。R2:決定係数(1に近いほど相関があることを示す)。
- (F)ネットワークの密度とコフィリンによる分解のしやすさの関係を示す散布図。分解のしやすさ(縦軸)は光照射停止後のアクチン蛍光の減少を基に定量した。縦軸の数字が1より大きいほど分解されやすく、1では全く分解されないことを示す。ネットワークの初期密度(横軸)が高くなるにつれコフィリンによる分解の効果は急激に抑制された。
本研究で開発した光によるアクチンネットワークの操作技術は、光強度だけでなく、光照射のオン/オフや照射領域を自在に調節できる点も強みです。さまざまな光照射パターンを試した結果、柱状の構造物だけでなく(図2B、3D)、薄いシート(図3C)やリング(図4)、山型など、さまざまな形状のアクチンの立体構造物をつくることができました。これは、「アクチン3Dプリンター」といえる新技術の実現を意味します。

図4 アクチン構造物の3次元デザイン
- (A)さまざまな光照射パターン。光照射の形や照射時間は任意に調節することができる。
- (B)コフィリン存在下で形成したさまざまなアクチン構造物。光照射停止後に徐々に構造物が人工脂質膜から浮遊し、分解していく様子が観察された。色の違いは、脂質膜上(0μm)からの高さ(Z)の変化を示している。
今後の期待
今回研究チームは、アクチンネットワークの密度が、アクチン結合タンパク質のネットワークへの入り込みやすさや機能を直接的に調節していることを実証しました。アクチン細胞骨格はがん細胞の浸潤や転移、胚発生の過程など、あらゆる細胞の変形現象に関与しています。本研究で開発した技術を用いてさまざまなアクチン結合タンパク質の機能を再検証していくことで、基礎研究や医学研究を問わず、細胞の変形現象に関わる広範な分野の理解が深まることが期待されます。また本研究で開発した技術は、生きた細胞においても適用できることから、アクチンが関与する細胞機能に対する光操作への応用も可能です。
さらに本研究では、光照射の強さや形を調節することで、アクチンネットワークの3次元構造を自在に構築できることを示しました。いわばアクチンを素材とする3Dプリンターともいえる本技術は、細胞内の構造物を模倣することで細胞運動の構成的な理解に貢献するだけでなく、生体親和性の高い分子ロボットの設計・制御といった、材料工学的分野への応用も期待されます。
補足説明
- 1.細胞骨格、アクチン分子
アクチン1分子は直径約5nmの球状タンパク質。アクチンが集合してひも状になったアクチン繊維は、細胞の形や運動、細胞小器官の輸送などに関わる細胞骨格として機能する。アクチン分子をヒトのサイズ(1m)とすると、アクチンネットワークのサイズは1km程度になる。 - 2.NPF
アクチンの核形成を促進するタンパク質を指す。NPFがアクチンの枝分かれに必要なArp2/3複合体およびアクチンと結合することで、ネットワークが形成される。本研究では、動物細胞で普遍的に存在するNPFの一種であるWAVE1と呼ばれるタンパク質のArp2/3結合部位を、光遺伝学に用いられるタンパク質SspBと連結することで、光照射によってNPFが脂質膜上へ集積するようデザインした。NPFはNucleation Promoting Factorの略。 - 3.ミオシン
アデノシン三リン酸(ATP)を加水分解する際に産生されるエネルギーを利用して力を発生させるモーター分子の一種。ミオシン同士で複合体を形成しミオシン繊維となり、さらに細胞骨格であるアクチン繊維と結合する。ミオシンがアクチン繊維上を滑るように動くことで、収縮力が発生する。本研究での再構成実験では、平滑筋ミオシンを用いた。 - 4.コフィリン
アクチンに結合して、アクチン繊維を切断、分解する活性を持つタンパク質。 - 5.光遺伝学
光によって活性化されるタンパク質の性質を利用し、細胞の機能を操作する技術。本研究ではiLIDとSspBと呼ばれる、青色光照射によって結合し暗条件下で可逆的に解離する2種類のタンパク質の組み合わせを利用した。
研究チーム
理化学研究所 生命機能科学研究センター
構成的細胞生物学研究チーム(研究当時)
基礎科学特別研究員 山本 啓(ヤマモト・ケイ)
(研究当時、現 シカゴ大学 研究員、理研 生命医科学研究センター 構成的細胞生物学研究チーム 客員研究員)
チームリーダー 宮﨑 牧人(ミヤザキ・マキト)
(研究当時、現 生命医科学研究センター 構成的細胞生物学研究チーム チームディレクター)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本学術振興会(JSPS)科学研究費助成事業特別研究員奨励費「in vitro再構成と光遺伝学の融合による細胞運動の普遍原理の解明(研究代表者:山本啓)」、同若手研究「アクチン細胞骨格とオルガネラ間における空間的競合関係の構成的理解(研究代表者:山本啓)」、同挑戦的研究(萌芽)「アクチン細胞骨格を直接操作できるオプトジェネティクスツールの開発(研究代表者:宮﨑牧人)」、同学術変革領域研究(A)「生体内力作用の定量的計測技術開発(研究分担者:宮﨑牧人)」、科学技術振興機構(JST)戦略的創造研究推進事業さきがけ「アクチン細胞骨格動態の構成的理解と制御(研究代表者:宮﨑牧人)」、理化学研究所Incentive Research Project(研究代表者:山本啓)、同基礎科学特別研究員研究費(研究代表者:山本啓)による助成を受けて行われました。
原論文情報
- Kei Yamamoto, and Makito Miyazaki, "Optogenetic actin network assembly on lipid bilayer uncovers the network density-dependent functions of actin-binding proteins", Nature Communications, 10.1038/s41467-025-62653-6
発表者
理化学研究所
生命機能科学研究センター 構成的細胞生物学研究チーム(研究当時)
基礎科学特別研究員(研究当時)山本 啓(ヤマモト・ケイ)
チームリーダー(研究当時)宮﨑 牧人(ミヤザキ・マキト)
(現 生命医科学研究センター 構成的細胞生物学研究チーム チームディレクター)
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
