理化学研究所(理研)生命機能科学研究センター 染色体分配研究チームのシュウ・エンタク 大学院生リサーチ・アソシエイト、北島 智也 チームディレクターらの研究チームは、老化した卵子[1]の染色体数異常を抑止する技術の開発に成功し、卵子の老化を克服する「人工動原体[2]によるおとり戦略」を提唱しました。
本研究成果は、母体の加齢に伴い頻度が上昇する卵子の染色体数異常の機序解明に貢献するとともに、高齢による不妊や流産のリスクを克服するための技術開発に向けた研究を切り開くものとして期待されます。
卵子の染色体数異常は、卵母細胞[1]の減数分裂[3]における染色体の早期分離によって引き起こされ、不妊・流産や、ダウン症[4]などの原因となります。老化した卵母細胞では、染色体分配装置である紡錘体[5]の微小管[5]と染色体の接続が過剰になっており、そのため染色体の早期分離が誘発されやすくなっています。
今回、研究チームは、動原体タンパク質を集積させたタンパク質粒子の集合体「人工動原体クラスタ」を老化マウスの卵母細胞に生成させることで、染色体の早期分離を防止し、卵子の染色体数異常を抑止できることを示しました。人工動原体クラスタは、微小管と自律的に接続する能力を持ち、染色体に接続しようとする微小管に対する「おとり」として働くことで、微小管と染色体の過剰な接続を抑える効果を持っていました。この成果は、卵母細胞の染色体の早期分離を防止し、老化卵子の染色体数異常を効果的に抑止した初めての成功例です。
本研究は、科学雑誌『Nature Cell Biology』オンライン版(11月4日付:日本時間11月4日)に掲載されます。
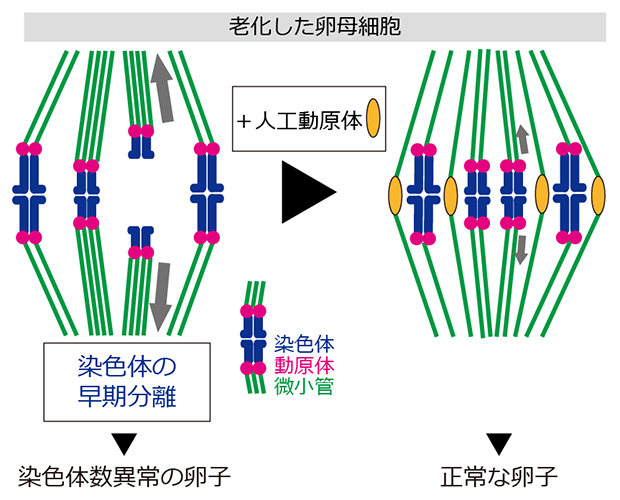
人工動原体を微小管の「おとり」にして染色体数異常を抑える卵子老化の克服戦略
背景
卵子は、精子と受精することで次世代を生む細胞です。卵子や精子の染色体数が異常になると、両親から次世代に受け継がれる遺伝情報に過不足が生じ、受精した後の胚発生に異常を来します。染色体数異常の胚の多くは着床までに失われ、着床したとしても流産する場合がほとんどです。また、21番染色体の過剰がダウン症を引き起こすなど、一部の先天性疾患の原因にもなります。卵子は精子よりも染色体数異常になりやすく、卵子の染色体異常は、母体の加齢とともに極めて高い頻度に上昇し、平均では33歳以上で50%を超えます注1)。このことは、高齢での不妊治療における最大の壁の一つです。少子化、晩婚化、高齢化が進行する現代社会において、加齢に伴う卵子の染色体数異常を抑止する技術の開発が求められています。
卵子の染色体数異常は、その前駆細胞である卵母細胞の減数分裂における染色体分配エラーによって起こります。研究チームはこれまで、自然老化マウスを研究モデルに用い、加齢に伴う卵母細胞の染色体分配エラーの原因を解明してきました。若い卵母細胞では、染色体分配装置である紡錘体の微小管によって各染色体が両方向に引っ張られ、正しいタイミングで一斉に染色体が分離することで、正常な染色体分配が達成されます。一方、老化した卵母細胞では、染色体の接着が弱まっており、紡錘体の微小管で引っ張られる力に耐えられず、早めのタイミングで分離する染色体が見られます(染色体の早期分離)注2、3)。早期分離した染色体は、紡錘体の微小管と正しく再接続できず、染色体分配エラーに至ります。つまり、加齢に伴う卵子の染色体数異常の主要な原因は、染色体の早期分離です。
研究チームは、染色体の早期分離を防止する技術を開発することで、加齢に伴う卵子の染色体数異常を抑止することができると考えました。その開発のための手がかりとなったのは、人工動原体ビーズ[6]の開発です注4)。老化マウス卵母細胞に人工動原体ビーズを注入すると、染色体の早期分離がわずかながら抑えられることを見いだしていました注2)。人工動原体ビーズが染色体の早期分離を防ぐ機序は依然として明らかではなかったものの、この観察は、人工動原体の改良が染色体の早期分離を効果的に防ぐ技術につながる可能性を示していました。
- 注1)Gruhn JR, Zielinska AP, Shukla V, et al. Chromosome errors in human eggs shape natural fertility over reproductive life span. Science. 2019 Sep 27;365(6460):1466-1469.
- 注2)2015年7月1日プレスリリース「加齢による卵子の染色体数異常の原因を特定」
- 注3)2024年7月19日プレスリリース「卵子の老化で小さな染色体が正しく分配されない原因」
- 注4)2024年9月20日プレスリリース「常識外れの新設計!世界初の人工動原体ビーズ」
研究手法と成果
研究チームは、染色体の早期分離を抑える効果がより高い人工動原体の設計を目指しました。先行研究で開発した人工動原体ビーズは、実際の染色体サイズに近い直径数マイクロメートル(μm、1μmは100万分の1メートル)のビーズを土台とし、そこに動原体タンパク質NDC80-NUF2ヘテロ二量体[6]を集積させたものです。しかし用いたビーズは人工物であるため、生体への適合性として課題がありました。そこで人工動原体の土台としてタンパク質粒子を用い、卵母細胞内で大量に自己集合させることで、人工動原体の効果を増大させることができるのではないかと考えました。
具体的には、人工動原体の材料となるタンパク質群のそれぞれをコードするメッセンジャーRNA(mRNA)[7]を試験管内で合成し、それらを混合してマウス卵母細胞に顕微注入しました(図1)。注入されたmRNAが卵母細胞で発現すると、自己集合するナノスケール(約40ナノメートル、nm、1nmは10億分の1メートル)のタンパク質粒子の表面に動原体タンパク質NDC80-NUF2ヘテロ二量体が集積し、さらに粒子間の結合を促す薬剤を添加することで、サブマイクロスケールの人工動原体クラスタ(直径約500nm)が生成されました。マウス卵母細胞内で大量に生成されたこれらの人工動原体クラスタは、染色体分配装置である紡錘体に取り込まれる能力を持っていました(図1)。
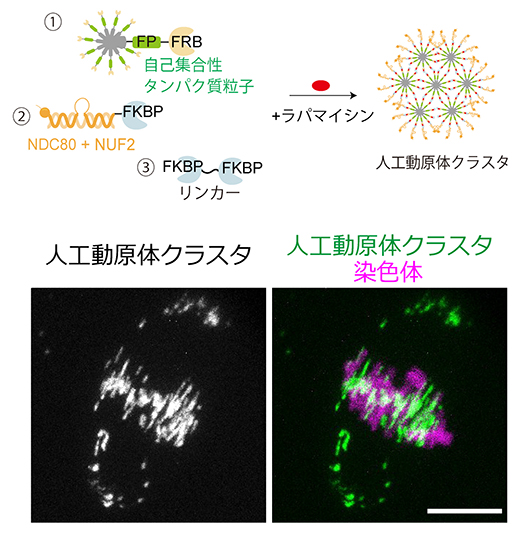
図1 タンパク質を土台としたサブマイクロスケールの人工動原体クラスタ
- 上)実験の概要。人工動原体の材料となるタンパク質は3種類あり、①自己集合性のタンパク質粒子、②動原体タンパク質NDC80-NUF2ヘテロ二量体、③タンパク質粒子同士を結合させるリンカータンパク質である。それぞれのタンパク質にはFKBPあるいはFRBと呼ばれる結合ドメインが付加されており、FKBPとFRBは薬剤(結合誘導剤ラパマイシン)存在下で結合する機能を持つ。これらのタンパク質をコードするmRNAを試験管内で合成し、混合してマウス卵母細胞に顕微注入して培養液中にラパマイシンを添加すると、タンパク質粒子同士が集合して直径約500nmの人工動原体クラスタが細胞内で生成された。人工動原体クラスタの挙動は、タンパク質粒子に組み込まれた蛍光タンパク質(FP)により蛍光顕微鏡で観察できる。
- 下)卵母細胞において生成された人工動原体クラスタ(左写真の白色シグナル、および右写真の緑色シグナル)。その多くは染色体と同様に紡錘体赤道面で整列している。染色体はヒストンタンパク質(H2B)で可視化している(右写真のマゼンタ)。スケールバーは10マイクロメートル。
染色体は、紡錘体の両極から伸びた微小管と動原体で接続して両方向に引っ張られることにより、紡錘体の赤道面に整列します。染色体と同様に、今回生成した人工動原体クラスタは、紡錘体の両極から伸びた微小管と接続し、紡錘体の赤道面に整列する能力を持っていました(図2)。このように機能的な人工動原体を、タンパク質のみを材料として組み立てることに成功したのは、世界で初めてのことです。
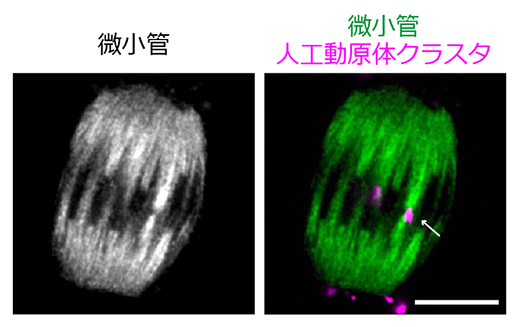
図2 紡錘体微小管と接続する人工動原体クラスタ
人工動原体クラスタは紡錘体の両極から伸びた微小管に両方向から捕えられ、赤道面に整列する(白矢印で示したマゼンタ)。微小管は微小管結合タンパク質(HURP)で可視化(左写真の白色シグナル、および右写真の緑色シグナル)。スケールバーは10μm。
次に、これらの人工動原体クラスタが、卵母細胞において染色体にどのような効果をもたらすのかを調べました。人工動原体クラスタを持つ卵母細胞では、染色体上の動原体(天然動原体)に接続する微小管の束(バンドル)が細くなっていました(図3)。このことは、人工動原体クラスタと天然動原体は微小管との結合に対して競合する関係にあり、人工動原体クラスタは染色体上の動原体から微小管バンドルを奪い取ることを示しています。実際に、人工動原体クラスタの微小管接続安定性をより高めると、染色体上の動原体に接続する微小管バンドルがさらに細くなり、染色体の整列を乱してしまいました。そこで、人工動原体クラスタの微小管接続安定性を調整することで、染色体の整列を乱すことなく、染色体上の動原体に接続する微小管バンドルを細くする条件を見つけました。この条件において、人工動原体クラスタは、染色体の正常な整列に必要な微小管バンドルは残しながら、過剰な分だけ染色体から取り除いたと考えられます。
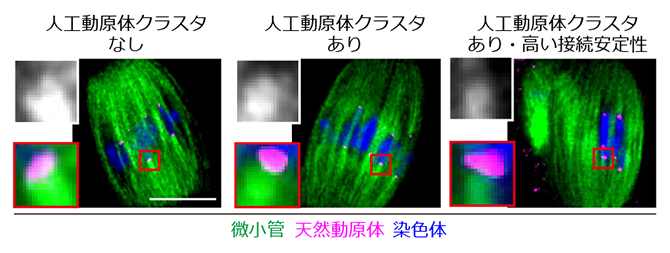
図3 紡錘体微小管と接続する人工動原体クラスタ
人工動原体クラスタが微小管を奪うことで、天然動原体に接続する微小管バンドルが細くなる(中、モノクロ拡大写真の白色シグナル、およびカラー拡大写真の緑色シグナル)。人工動原体の微小管接続安定性が高いほど、その効果は顕著になる(右)。微小管は、微小管結合タンパク質(HURP)で可視化。スケールバーは10μm。
この人工動原体クラスタは、老化に伴う卵子の染色体数異常の原因である、染色体の早期分離を抑止する効果を持つと期待できます。なぜなら、染色体の早期分離は、染色体が微小管によって引っ張られる力に耐えきれずに起こるためであり、人工動原体クラスタが存在するとその力が分散されると考えられるからです。そこで、老化した雌マウスの卵母細胞において人工動原体クラスタを生成させたところ、染色体の早期分離が劇的に減少しました(図4)。一方で、染色体の整列やその後の分配には悪影響を及ぼしませんでした。その結果、減数分裂を経て成熟した卵子では老化に伴う染色体数異常が抑えられ、正常な数の染色体を持った卵子の形成が促進されました。すなわち、人工動原体クラスタは微小管に対して「おとり」として機能し、染色体上の動原体を過剰な微小管接続から守ることで、染色体の早期分離を防ぎ、卵子の染色体数異常を抑止したと考えられます。
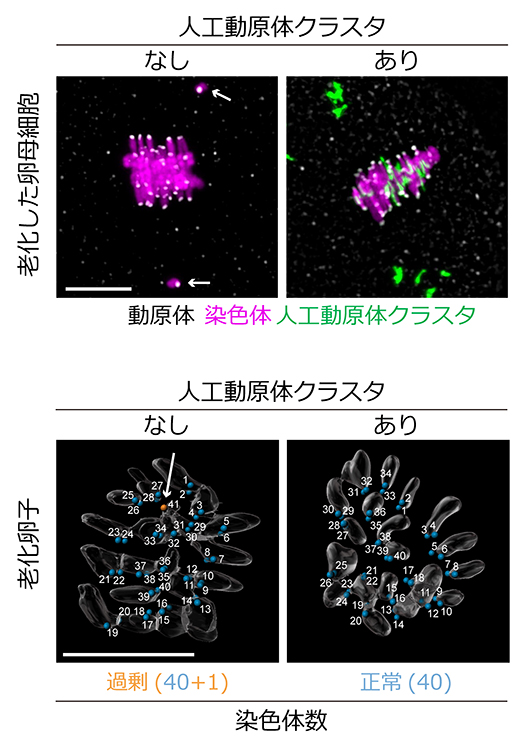
図4 染色体の早期分離を抑制する人工動原体クラスタ
- 上)老化した卵母細胞をProTAME(細胞分裂の進行阻害剤)で処理し、減数第一分裂中期に停止させて観察した。分裂中期の染色体は赤道面に並ぶはずが、老化した卵母細胞では一部の染色体が早期分離し、両極に移動している(矢印)。一方、人工動原体クラスタを持つ老化卵母細胞では染色体の早期分離が抑止された。スケールバーは10μm。
- 下)老化した卵母細胞に人工動原体クラスタを持たせて減数第二分裂まで進行させ、受精可能な卵子(老化卵子)へと成熟させた。染色体と動原体の画像を3次元再構築し、動原体(スポットで表示)の数をカウントすることで染色体数を決定した(減数第二分裂は受精により完了するため、この時期のマウス卵子の正常な染色体数は2n=40)。人工動原体クラスタのない老化卵子では染色体数の過不足が頻繁に見られた(上の例は矢印で示す1本が過剰で、41本)のに対し、人工動原体クラスタありではその頻度が減少していた。スケールバーは10μm。
今後の期待
本研究により、老化したマウスの卵母細胞で高頻度に見られる染色体数異常を抑止し、正常な数の染色体を持つ卵子の形成を促進する技術が実現しました。この成果は、高齢女性の不妊や流産、ダウン症など胎児の先天性疾患のリスクを克服する生殖補助技術に向けた研究を促すことが期待されます。
本成果にはいくつかの留意点があります。第一に、本研究は加齢に伴う卵子の染色体数異常を抑止できる技術を示したものの、それがその後の卵子の受精、さらには胚発生を通した正常性を担保するかはまだ示されていません。この点についてはさらなる研究が必要ですが、本研究で設計された人工動原体クラスタは薬剤添加により生成・分解を誘導できる仕掛けを含んでいるため、受精や胚発生を妨げないように人工動原体クラスタを制御することに技術的障壁はないと考えられます。
第二に、本成果は老化マウスをモデルにしたものであり、ヒト卵子の染色体数異常を抑止できるかはまだ示されていません。ヒト卵子の染色体数異常の主要な原因は、本研究で防止に成功した染色体の早期分離を含みますが、他の原因もあることが疑われています。ヒト卵子の染色体数異常の原因を多角的に理解するための研究が必要です。
第三に、本研究では成長した卵母細胞(GV卵[8]と呼ばれる)を採卵し、そこに人工動原体クラスタを生成させ、卵子へと成熟させる培養(体外成熟培養[9]、IVM培養[9]と呼ばれる)を行うことで、卵子の染色体数異常を抑止しました。一方で、現在の不妊治療に用いられる生殖補助技術の標準的な手順は、成熟した卵子を直接採卵するものであり、IVM培養のステップを含んでいません。仮に、本研究で開発した戦略を生殖補助技術に応用するのであれば、GV卵を採卵してIVM培養するプロトコルを採用する必要があります。生殖補助技術におけるIVM培養をより広く採用することへの議論が期待されます。
本研究において、老化した卵子における染色体数異常を抑止する戦略が示されました。女性における生殖ライフスパンの限界を克服する技術へ向けたさらなる研究と、その技術を応用することへの医学的および倫理的な議論が広まることが期待されます。
補足説明
- 1.卵子、卵母細胞
卵子は女性由来の受精可能な生殖細胞。卵母細胞は受精能を持たない発達前の生殖細胞で、女性の胎児期に形成され、卵巣内に蓄積される。卵母細胞が長期の休眠期を経て、排卵直前に減数第一分裂を行い、卵子となる。受精によって、減数第二分裂が起こり、受精卵として発生を開始する。 - 2.動原体
動原体は染色体のくびれ部分の上に形成されるタンパク質複合体。染色体分配の際に、微小管が染色体を動かすためのけん引部位となる。体細胞分裂では姉妹染色分体のそれぞれに動原体が一つずつ形成され、減数第一分裂では相同染色体のそれぞれに動原体が一つずつ形成される。 - 3.減数分裂
真核生物の生殖器官(精巣や卵巣)にある生殖細胞で見られ、配偶子(精子や卵子)をつくるため、二つの分裂が連続して起きる特別な様式の細胞分裂。生殖細胞である卵母細胞の中の染色体は減数第一分裂に入ると凝集し、マウスにおいては20本の染色体になる。個々の染色体は4本の染色分体から成る二価染色体を形成する。分裂期中期になると、染色体の動原体に微小管が接合し、染色体は両極から張力を受ける。分裂期終期になると、二価染色体は分配され、一価染色体になる。 - 4.ダウン症
21番染色体が1本余分に存在し3本となる(トリソミー)ために引き起こされる先天性疾患。約9割が卵母細胞の減数分裂における染色体分配の誤りに起因している。 - 5.紡錘体、微小管
紡錘体は、細胞分裂において染色体を分配するための構造体。微小管は、タンパク質が重合して管状構造を形成した細胞骨格の一種。紡錘体は微小管重合中心とそこから伸びてくる微小管で構成される。紡錘体の両極から伸びてきた微小管は、染色体上の動原体に接合し、染色体に張力をかけて分配へと導く。 - 6.人工動原体ビーズ、NDC80-NUF2ヘテロ二量体
人工動原体ビーズは、抗GFP(緑色蛍光タンパク質)抗体が結合した磁気ビーズに、動原体タンパク質であるNDC80およびNUF2の2種類から成るタンパク質の二量体(NDC80-NUF2ヘテロ二量体)を結合させたもの。卵母細胞の中で人工動原体ビーズは、紡錘体の中期板に整列し、染色体よりも紡錘体の内側に入り込む。人工動原体ビーズは老化した卵母細胞における早期分離の頻度を有意に減少させることができたが、この作用が人工動原体ビーズ本来の染色体の本来の場所を人工動原体ビーズが占有したためか、微小管の引っ張る力を弱めたためかは分かっていなかった。 - 7.メッセンジャーRNA(mRNA)
DNAから転写され、細胞が合成するタンパク質のアミノ酸の並び方の情報を持つRNA。試験管内で合成したmRNAを細胞に注入することで、目的のタンパク質を速やかに発現することができる。 - 8.GV卵
第一減数分裂前期で停止した卵母細胞。卵の明瞭な核(卵核胞、Germinal Vesicle)が観察できることからGV卵と呼ばれる。 - 9.体外成熟培養、IVM培養
卵母細胞を試験管内で受精可能な卵子に成熟させる(in vitro maturation)手法。標準的な生殖補助医療では、成熟卵を採卵して体外受精や顕微授精を行うが、未成熟卵しか得られない場合などに用いられる。
研究チーム
理化学研究所 生命機能科学研究センター
染色体分配研究チーム
大学院生リサーチ・アソシエイト シュウ・エンタク(Zhou Yuanzhuo)
(京都大学 大学院生命科学研究科 大学院生)
研究パートタイマーⅠ 浅井 皓平(アサイ・コウヘイ)
客員研究員 京極 博久(キョウゴク・ヒロヒサ)
(神戸大学 大学院農学研究科 准教授)
チームディレクター 北島 智也(キタジマ・トモヤ)
(生命機能科学研究センター 副センター長、京都大学 大学院生命科学研究科 客員教授)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本学術振興会(JSPS)科学研究費助成事業学術変革領域研究(A)「動的な生殖ライフスパン:変動する生殖細胞の機能と次世代へのリスク(領域代表者:北島智也)」、同基盤研究(B)「哺乳類卵母細胞における紡錘体二極化の機構の解明」、同基盤研究(A)「人工動原体の構築による染色体分配の機構の解明(研究代表者:北島智也)」、内藤記念科学振興財団特定研究助成金「卵母細胞における染色体分配エラーの時空間経路の解明」および理研新領域開拓課題「長時間分子生物学(領域代表者:北島智也)」による助成を受けて行われました。
原論文情報
- Yuanzhuo Zhou, Kohei Asai, Hirohisa Kyogoku, Tomoya S. Kitajima, "Designing protein-based artificial kinetochores as decoys to prevent meiotic errors in oocytes", Nature Cell Biology, 10.1038/s41556-025-01792-w
発表者
理化学研究所
生命機能科学研究センター 染色体分配研究チーム
大学院生リサーチ・アソシエイト シュウ・エンタク(Zhou Yuanzhuo)
チームディレクター 北島 智也(キタジマ・トモヤ)
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
