2026年1月6日
理化学研究所
自然科学研究機構生命創成探究センター
科学技術振興機構(JST)
小胞体による細胞外基質のナノ加工作用を発見
-分子フィルターなど生物模倣技術の開発に貢献へ-
理化学研究所(理研)生命機能科学研究センター 形態形成シグナル研究チーム(研究当時)の稲垣 幸 テクニカルスタッフⅠ(研究当時)、林 茂生 チームリーダー(研究当時、現 発生ゲノムシステム研究チーム 客員主管研究員)、細胞場構造研究チーム(研究当時)の岩根 敦子 チームリーダー(研究当時)、自然科学研究機構 生命創成探究センター(ExCELLS)の村田 和義 特任教授らの共同研究グループは、細胞外基質[1]の一つ、昆虫の体表面を覆うクチクラ[1]のナノメートル(nm、1nmは10億分の1メートル)サイズの微細構造が、細胞内の小胞体[2]と細胞膜の相互作用によって生み出されることを発見しました。
生物の体表面にはしばしば微細な構造が見られ、光の波長や分子をサイズで選別する機能を有します。これをヒントに、構造色[3]の発色加工や分子フィルターの製造など、新規の工業製品開発が進められています。本研究成果は、機能的にデザインしたクチクラの微細構造を昆虫で発現させて試作するなど、バイオミメティクス[4](生物模倣)分野の技術開発に貢献すると期待されます。
今回、共同研究グループは、ショウジョウバエの嗅覚器官(嗅覚毛細胞)を覆うクチクラに存在する微小な穴(ナノポア)の形成メカニズムを詳細に調べました。電子顕微鏡観察の結果、嗅覚毛細胞には小胞体ネットワークが顕著に発達していることが分かりました。さらに、小胞体に発現するGore-tex(Gox)タンパク質[5]が小胞体を分解し、細胞膜の過剰な拡張と細胞膜の取り込みを促進することを示しました。この作用により細胞膜は周期的に湾曲・陥入し、その外側のクチクラに対して周期的なナノポアの形成を促していました。本研究は細胞外分子の生産拠点として知られていた小胞体がクチクラのパターン形成にも関わる新規機能を明らかにしたものです。
本研究は、科学雑誌『Journal of Cell Biology』オンライン版(2025年12月29日付)に掲載されました。
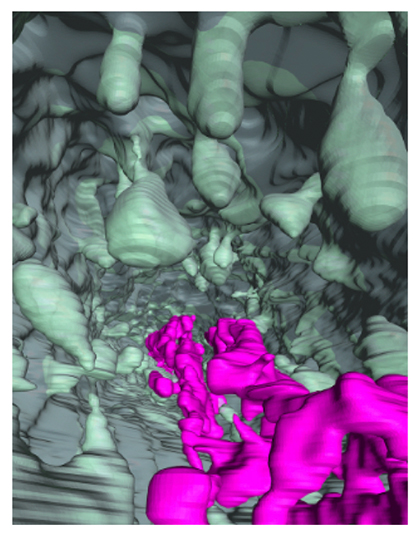
細胞の内側から見た、陥入した細胞膜(灰緑)と発達した小胞体(マゼンタ)
背景
多くの生物は、体表面を覆う細胞外基質にさまざまな微細加工を施すことで波長選択的な光吸収や分子フィルターなどの表面機能を付与します。例えばチョウの翅(はね)を覆うキチン[6]を主体とする鱗粉(りんぷん)やクジャクの羽を構築するケラチン[7]は、光の選択的反射特性を有する微細な多孔性構造によって鮮やかな構造色を帯びます。このような構造色は、セルロース[6]を主体とする植物の細胞壁にも観察されます。またハスの葉は、表面に存在する多数の微細突起により高い撥水(はっすい)性を示します。同様の構造は昆虫の複眼表面にも見られ、撥水性と共に高い光吸収能を発揮して鋭敏な光受容を助けます。これらの生物では、多糖類[6]のキチンやセルロース、タンパク質のケラチンなどの細胞外基質を加工する仕組みが存在し、類似した機能を発揮するように収斂(しゅうれん)的に進化してきたと考えられています。しかし、細胞外基質をナノメートルサイズで加工する仕組みに関する知見は、いずれの生物においてもこれまで得られていませんでした。特に、数十マイクロメートル(μm、1μmは100万分の1メートル)サイズの細胞が、自身よりもはるかに小さなナノメートルサイズの構造体をどのようにして規則正しく正確につくり出すのかについては大きな謎でした。
昆虫の体表面を覆う細胞外基質は「クチクラ」と呼ばれ、軽くて丈夫な外骨格を形成しています。嗅覚器官である毛細胞(嗅覚毛細胞)が分泌するクチクラには、直径30~50nmの穴(ナノポア)が多数開いており、大気中の匂い分子(数nm)を通過させつつ、ウイルス(>100nm)や大気汚染粒子(>1μm)は排除する選択的分子フィルターとして嗅覚受容ニューロンを保護しています。林チームリーダーらは先行研究で、ショウジョウバエのgore-tex(gox)/Osiris23遺伝子[5]が、ナノポアの形成と正常な嗅覚に必須であることを発見しました注1)。本研究では、ナノポアの形成過程におけるgox遺伝子の機能を詳細に調べました。
- 注1)2019年4月19日プレスリリース「昆虫の外骨格にナノサイズの穴が開く仕組み」
研究手法と成果
gox遺伝子は嗅覚器官の嗅覚毛細胞に発現しますが、他のクチクラ分泌細胞には発現していません。gox遺伝子産物(Goxタンパク質)が細胞内のどこに存在しているかを調べたところ、Goxタンパク質は小胞体に局在し、さらに嗅覚毛細胞のナノポア形成領域では細胞膜に近接した膜構造にも局在が見られました(図1)。
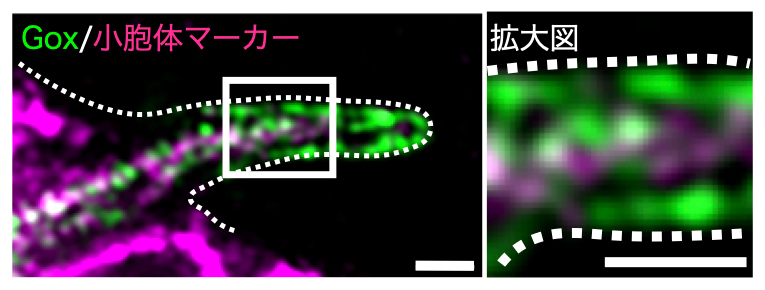
図1 小胞体と細胞膜に局在する膜タンパク質Gox
ショウジョウバエの蛹(さなぎ)(蛹殻(ようかく)形成後44時間)で形成中の嗅覚毛細胞の蛍光顕微鏡像。Goxタンパク質を緑で、小胞体で発現するタンパク質マーカー(Cnx99A)をマゼンタで示す。破線は細胞膜を示す。Goxタンパク質の一部は小胞体に局在する一方、ナノポアが形成される突起部分では、細胞膜に近接した膜構造にも強い局在が見られた。スケールバーは1μm(拡大図も同じ)。
次に、嗅覚毛細胞における小胞体の分布を、FIB-SEM[8]を用いて取得した電子顕微鏡画像の3次元再構築法を用いて調べたところ、中心軸に沿って顕著に発達した小胞体のネットワークが嗅覚毛細胞に観察されました(図2中)。一方、嗅覚毛細胞と同じように毛を持つ細胞でも、非感覚細胞の突起にはここまで発達した小胞体は見られませんでした(図2左)。また、ナノポアを形成できないgoxの変異体では、嗅覚毛細胞の小胞体ネットワークはさらに発達し、細胞内全体にわたって広がっていました(図2右)。
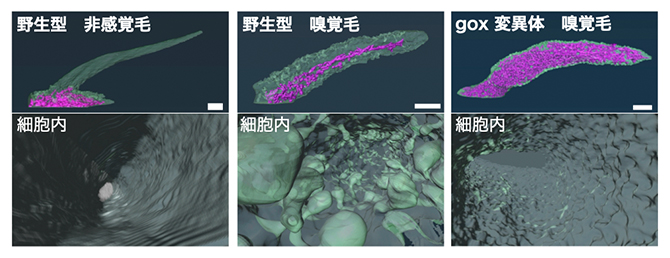
図2 非感覚毛と嗅覚毛、gox変異体における小胞体と細胞膜形状の比較
FIB-SEMを用いて3次元再構成した細胞膜の形状(蛹殻形成後44時間)。外形(上図)と内部構造(下図)をそれぞれ示す。外形図では、小胞体の分布をマゼンタで重ねた。嗅覚毛細胞では突起部分に小胞体が発達し、細胞膜が内部に向かって陥入する構造が多数見られた(中)。これらの特徴は、非感覚毛細胞(左)の突起部分では観察されなかった(左)。また、ナノポアを形成できないgox変異体では、嗅覚毛細胞の小胞体ネットワークはさらに発達し、細胞内全体にわたって広がっていたが、細胞膜の陥入構造は減少した(右)。スケールバーは1μm。
そこで、小胞体のダイナミクスとナノポア形成の関係を調べるため、小胞体分解に関わるオートファジー経路[9]を阻害する実験を行いました。小胞体のサイズは、成長と分解のバランスで決まります。オートファジー経路を阻害した嗅覚毛細胞では、gox変異体と同様に、小胞体の過剰成長とナノポアの消失が見られました。さらに、Goxタンパク質と相互作用する分子を探索したところ、オートファジーを制御する因子として知られるp62/SQSTM[10]のショウジョウバエ相同分子Ref(2)P[10]が同定されました。以上の結果から、Goxタンパク質はオートファジーによる小胞体分解の経路を介して、ナノポア形成を行うと考えられました。
共同研究グループは次に、FIB-SEMデータを分析して嗅覚毛細胞の細胞膜の構造を調べました。すると嗅覚毛細胞の細胞膜は、他の細胞に比べて多数の皺(しわ)を持った湾曲した構造であることが分かりました。これを細胞の内側から観察すると、細胞膜の陥入が多数観察されました(図2下図)。この陥入構造は、細胞膜を内部に取り込むエンドサイトーシス[11]の中間構造に類似しています。これらの細胞膜の皺と陥入構造は、gox変異体や、小胞体を断片化する処理を施した感覚毛細胞においては減少していました。従ってGoxタンパク質は小胞体を介して、細胞膜の湾曲と陥入を制御すると結論づけられました。
細胞膜に現れる多数の陥入構造が活発なエンドサイトーシスを示しているとすれば、その役割はどのようなものなのでしょうか。エンドサイトーシスは、細胞膜が陥入してできたくびれ構造を、ダイナミン[12]分子が重合したリングが取り囲んで切断し、膜小胞が細胞膜から分離することで完了します。ダイナミンの働きを阻害して膜小胞の分離を抑制したところ、嗅覚毛細胞の細胞膜陥入構造の数が増加しました。さらに予想外なことに、ダイナミン変異型の嗅覚毛では、小胞体の量が大幅に増大していました(図3)。これは、ダイナミンの阻害により小胞体の分解が抑制されたことを示唆します。ダイナミンは主に細胞膜で機能することから、嗅覚毛細胞では細胞膜→ダイナミン→陥入構造切断→小胞体分解の経路が存在することが分かりました。

図3 ダイナミン変異型での小胞体の増大
嗅覚毛細胞内部の細胞膜(灰緑)と小胞体(マゼンタ)を、野生型とダイナミン変異型で比較した。ダイナミン変異型では細胞膜陥入構造の数が増加し、さらに小胞体の量も大幅に増大した。スケールバーは200nm。
以上の知見を合わせると、嗅覚毛細胞ではGoxタンパク質が制御する小胞体分解から細胞膜陥入に至る経路と、細胞膜からダイナミンを介して小胞体分解に至る経路が対を成していることが分かりました。二つの経路は互いに促進し合う正のフィードバックをなすことで、継続的な小胞体分解が起こると理解されます。オートファジーで分解された小胞体成分(脂質)は細胞膜に供給され、膜の過剰な成長を促すことで細胞膜を湾曲させるものと考えられました(図4)。林チームリーダーらの先行研究で細胞膜の陥入点はナノポアの形成部位によい一致を示すことが分かっていました注1)。従ってGoxタンパク質と小胞体は細胞膜形態を皺状に改変させることで、細胞の外側での周期的なナノポア形成を制御すると結論づけられました。
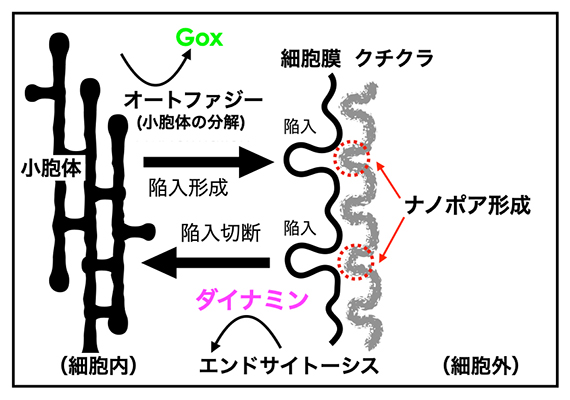
図4 小胞体と細胞膜の相互作用によってナノポアが生み出されるモデル図
小胞体のGoxタンパク質はオートファジーによる小胞体分解を介して、細胞膜を陥入させる。一方細胞膜のダイナミンは、エンドサイトーシスを介して小胞体を分解させる。この二つの経路は互いに促進し合う正のフィードバックをなすことで、継続的な小胞体分解が起こる。ナノポアは、細胞膜の陥入点に近いクチクラで形成される。
今後の期待
小胞体はその「小」の名に反して、連続した細胞膜の管とシートが連結して細胞核から細胞の周辺部までを網羅する最大の細胞小器官(オルガネラ)です。この連続性により、小胞体は細胞膜タンパク質や分泌物などを迅速に輸送する高速道路としての役割も果たします。本研究ではさらに、小胞体が嗅覚毛細胞の先端部にまでネットワークを張り巡らせることで、細胞膜成長の素材(脂質)を供給するとともに、細胞膜陥入の誘導を通じてナノポアの分布パターンを指定する機能を持つことも示唆しました。小胞体による微細構造構築の仕組みは、ナノポア形成以外にも働いているかもしれません。実際にチョウ類では、構造色を発する多孔性の鱗粉クチクラ形成に先立って、小胞体が規則的に配列する様子が観察されています注2)。
一方で、小胞体のGoxタンパク質がどのように細胞膜の陥入を引き起こすのか、また細胞膜のダイナミンが継続的な小胞体の分解にどう関わっているのかは明らかにはなっていません。細胞内部に存在する分子メカニズムだけでクチクラのナノ構造が説明できるわけではありません。林チームリーダーらは、嗅覚毛細胞の外側に存在する雲状の構造体(クラウドECM[13])が嗅覚毛細胞に対して圧縮力を与えることでナノポア形成を助けていることを見いだしています注3)。細胞の内側から働く小胞体と外側から働くクラウドECMの相互作用が重要だと考えられ、今後の研究を進めていきます。
クチクラのナノポア形成に十分な条件が同定できれば将来的に新たな機能的なクチクラ構造をデザインし、昆虫モデルで構築させることも期待されます。匂いや味覚の小分子の通過を許しつつ感覚器を保護するナノポアシートや、昆虫レンズを覆う高光吸収性の微細突起構造を模したコンタクトレンズへの適用など、現在は主に無機物素材が用いられているバイオミメティクスの製品を、生体適合性の高い素材で構築することも視野に入ってきます。
- 注2)Ghiradella, H. 1989. Structure and Development of Iridescent Butterfly Scales: Lattices and Laminae. Journal of Morphology 202. 69-88. doi: 10.1002/jmor.1052020106
- 注3)2026年1月5日プレスリリース「圧縮的な細胞環境をつくる細胞外基質の新機能」
補足説明
- 1.細胞外基質、クチクラ
細胞外基質(細胞外マトリックス)は、細胞と細胞の間を満たし、生体組織を包み込む高分子の構造体。昆虫の体表面を覆うクチクラは、表皮細胞が体表面に分泌するキチン([6]参照)を主体とする細胞外マトリックスで、軽くて丈夫な外骨格を形成する。 - 2.小胞体
管もしくはシート状膜から成る細胞内小器官で核膜から細胞周辺部にまでほぼ連続したネットワーク構造を取る。膜貫通タンパク質、分泌タンパク質と脂質の生産拠点の役割を担う。 - 3.構造色
色素が特定の波長の光を吸収することで発色するのに対して、光と構造体との物理的相互作用(干渉、回折、散乱など)によって発色する現象の総称。 - 4.バイオミメティクス
生物が進化の過程で獲得した形態、構造、物質などにヒントを得て、有用な素材や技術の開発に応用すること。生物模倣とも呼ばれる。 - 5.Gore-tex(Gox)タンパク質、gore-tex(gox)/Osiris23遺伝子
ショウジョウバエの嗅覚毛クチクラに存在するナノポアを形成する遺伝子およびタンパク質として同定された。gox変異体ではナノポアが喪失し嗅覚が低下する。gore-tex(gox)/Osiris23遺伝子は昆虫で保存されたOsiris遺伝子ファミリーの一員。 - 6.キチン、セルロース、多糖類
多糖類は糖分子が直鎖状に重合した高分子。単糖の一つN-アセチルグルコサミンが重合したキチンは昆虫や甲殻類の外骨格の主成分、別の単糖であるグルコースが重合したセルロースは植物の細胞壁の主成分となる。 - 7.ケラチン
脊椎動物の表皮細胞が生産するタンパク質で、皮膚や爪、髪の毛の主成分となる。髪の毛と相同な鳥類の羽、羽毛もケラチンからつくられ、さまざまな形と色を示す。 - 8.FIB-SEM
標本を埋め込んだ樹脂ブロック表面を収束イオンビーム(focused ion beam:FIB)で薄く切削(せっさく)し、走査電子顕微鏡(scanning electron microscope:SEM)によって表面像を取得するステップを繰り返すことで高精細な電子顕微鏡画像の3次元像を取得する技術。 - 9.オートファジー経路
細胞が自身の細胞質や細胞内小器官を分解することで緊急時の細胞維持に必要な栄養素(アミノ酸や脂質)を確保する現象。飢餓などのストレスで活性化される他にさまざまな生理状態で機能する。 - 10.p62/SQSTM、Ref(2)P
選択的オートファジーを実行する経路を構成する分子。一定の条件下でユビキチン小タンパクが目印として付加されたタンパク質をp62/SQSTMが認識してオートファジー経路に導く。Ref(2)Pはショウジョウバエ相同分子。 - 11.エンドサイトーシス
細胞が細胞膜を内向きの管状に潜り込ませて細胞外の物質を取り込む過程。細胞外部からの高分子取り込み、シグナル受容や、ウイルス感染などにおいて働く。 - 12.ダイナミン
エンドサイトーシスにおいて潜り込んだ細胞膜の細胞質側に集合して膜を切断することでエンドサイトーシスを完了させる分子。 - 13.クラウドECM
細胞を外部から包み込む新しいタイプの細胞外基質(Extracellular Matrix:ECM)で昆虫クチクラのナノポア構造形成に関わる。
共同研究グループ
理化学研究所 生命機能科学研究センター
形態形成シグナル研究チーム(研究当時)
テクニカルスタッフⅠ(研究当時)稲垣 幸(イナガキ・サチ)
(現 発生ゲノムシステム研究チーム 客員研究員)
テクニカルスタッフⅠ(研究当時)和田 宝成(ワダ・ホウセイ)
(現 発生ゲノムシステム研究チーム 上級テクニカルスタッフ)
研究員(研究当時)板倉 由季(イタクラ・ユキ)
(学振特別研究員RPD)
チームリーダー(研究当時)林 茂生(ハヤシ・シゲオ)
(現 発生ゲノムシステム研究チーム 客員主管研究員)
細胞場構造研究チーム(研究当時)
研究員(研究当時)板橋 岳志(イタバシ・タケシ)
(現 先端バイオイメージング研究チーム 客員研究員)
チームリーダー(研究当時)岩根 敦子(イワネ・アツコ)
(現 先端バイオイメージング研究チーム 客員主管研究員)
無細胞タンパク質合成研究チーム
技師 中川 れい子(ナカガワ・レイコ)
自然科学研究機構 生命創成探究センター(ExCELLS)
特任教授 村田 和義(ムラタ・カズヨシ)
(同 生理学研究所 生体分子構造研究部門 特任教授)
博士研究員 陳 林(Lin Chen)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、理研BDR-大塚製薬連携センター(RBOC)かけはしプログラム、日本学術振興会(JSPS)科学研究費助成事業挑戦的研究(開拓)「細胞外基質ナノ構造の生物学的構築原理の解明(研究代表者:林茂生、JP20K20460)」「昆虫の機能的ナノ構造を規定する遺伝子ファミリー(研究代表者:林茂生、JP24K21276)」、同学術変革領域研究(学術研究支援基盤形成)「先端バイオイメージング支援プラットフォーム(研究代表者(研究当時):鍋倉淳一、JP22H04926)」、科学技術振興機構(JST)戦略的創造研究推進事業CREST「生体内ナノ結晶構造の進化的起源の構成的理解(研究代表者:安藤俊哉、JPMJCR24B1)」、日本医療研究開発機構(AMED)生命科学・創薬研究支援基盤事業(BINDS)「生命分子動態機能解析システムによる創薬標的探索をめざした研究支援(研究代表者:村田和義、23ama121005)」による助成を受けて行われました。
原論文情報
- Sachi Inagaki, Housei Wada, Takeshi Itabashi, Yuki Itakura, Reiko Nakagawa, Lin Chen, Kazuyoshi Murata, Atsuko H. Iwane, Shigeo Hayashi, "Endoplasmic reticulum patterns insect cuticle nanostructure", Journal of Cell Biology, 10.1083/jcb.202503127
発表者
理化学研究所
生命機能科学研究センター
テクニカルスタッフⅠ(研究当時)稲垣 幸(イナガキ・サチ)
チームリーダー(研究当時)林 茂生(ハヤシ・シゲオ)
(現 発生ゲノムシステム研究チーム 客員主管研究員)
細胞場構造研究チーム(研究当時)
チームリーダー(研究当時)岩根 敦子(イワネ・アツコ)
自然科学研究機構 生命創成探究センター(ExCELLS)
特任教授 村田 和義(ムラタ・カズヨシ)
 左から林 茂生、稲垣 幸
左から林 茂生、稲垣 幸
発表者のコメント
今回の研究を通じて、自分の予想や仮説を超えたところに新しい発見があることを実感しました。先入観にとらわれず、目の前のデータを丁寧に観察することが、新たな発見につながったと感じています。さらに、新しい技術に臆せず挑戦する姿勢の大切さを改めて学びました。(稲垣 幸)
JST事業に関する問い合わせ
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
沖代 美保(オキシロ・ミホ)
Tel: 03-3512-3524
Email: crest@jst.go.jp
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
自然科学研究機構 生命創成探究センター(ExCELLS)研究力強化戦略室
Tel: 0564-59-5203
Email: press@excells.orion.ac.jp
科学技術振興機構 広報課
Tel: 03-5214-8404
Email: jstkoho@jst.go.jp
