理化学研究所(理研)生命機能科学研究センター 冬眠生物学研究チームの砂川 玄志郎 チームディレクターらの研究チームは、マウスの脳内で特定の細胞を操作する遺伝子工学技術において、遺伝子の最後に付加する「ポリA配列[1]」の選び方が、実験操作の精度を大きく左右することを発見しました。
本研究成果は、これまで「発現を強めるものほど良い」と考えられがちだった遺伝子工学のパーツ選択に対し、適切な相性の重要性を示すものであり、より精密で安全な遺伝子発現操作や疾患モデルマウスの作製に貢献すると期待されます。
今回、研究チームは、マウスを冬眠様状態(QIH)[2]にする神経(Q神経[2])を特異的に操作するため、異なるポリA配列を持つ複数の遺伝子改変マウスを作製・比較しました。その結果、従来型のポリA配列(SV40 polyA)と比べて一般的に遺伝子発現をより安定させ発現が強まるとされる「ウシ成長ホルモン由来ポリA配列(bGH polyA)」を用いると、標的以外の細胞でも遺伝子が働いてしまい、冬眠様状態を正確に誘導できなくなることを突き止めました。一方で、ポリA配列を挿入せず、本来の遺伝子の配列を利用した場合は、冬眠様状態の誘導は減弱するものの、遺伝子発現の高い精度が維持されました。これは、遺伝子発現の「強さ」だけでなく「質(特異性)」を制御するために、ポリA配列を含めた遺伝子の末尾のパーツ選択が極めて重要であることを示しています。
本研究は、科学雑誌『Journal of Comparative Physiology B』オンライン版(1月29日付)に掲載されました。
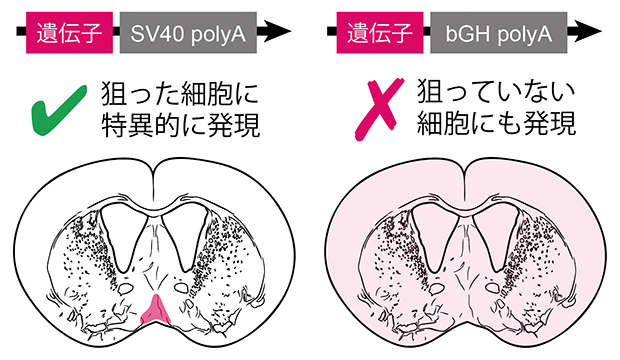
ポリA配列(polyA)の違いによるマウスの脳での遺伝子発現特異性の変化
背景
一部の哺乳類は、冬眠することで寒冷期や飢餓などの厳しい環境を乗り越えます。冬眠中の動物は、食物摂取量やエネルギー生産量が極端に減少し、体温や代謝が低い状態で生存できます。人間は冬眠しませんが、もし人工的に冬眠状態をつくり出せれば、救急医療において搬送中の患者を省エネルギー状態にして危機を切り抜けたり、移植治療で臓器を保存したりするなどの応用が期待できます。砂川チームディレクターらはこれまでに、マウスの視床下部にある「Q神経」を刺激することで、冬眠様状態(QIH)を誘導できることを発見しました注)。
このQIHを安全かつ確実に誘導するためには、Q神経「だけ」を狙ってスイッチタンパク質(Creリコンビナーゼ[3]などの酵素)を働かせる必要があります。視床下部は体温維持やホルモン分泌など自律機能に関わる中心器官であるため、もし標的以外の細胞も刺激してしまうと、体温調節や代謝のバランスが崩れ、正確な冬眠様状態がつくれなくなります。通常、こうした遺伝子改変マウスを作製する際には、導入した遺伝子を安定して強く発現させるために、「ポリA配列」と呼ばれるパーツを遺伝子の末尾に付加します。特に「ウシ成長ホルモン由来(bGH)」のポリA配列は非常に性能が高いため、多くの研究で標準的に使われてきました。しかし、この「強力なパーツ」が、Q神経のようなごく限られた細胞での精密な制御にどう影響するかは、これまであまり注目されてきませんでした。
- 注)2020年6月12日プレスリリース「冬眠様状態を誘導する新規神経回路の発見」
研究手法と成果
マウスでQIHを誘導できることを報告した先行研究では、Q神経でスイッチタンパク質を働かせるための遺伝子改変マウス(ノックインマウス[4])として、ウイルス由来のポリA配列である「SV40ポリA配列」を持つマウス(QC系統)を用いていました。本研究では、ポリA配列の構成だけを変えた以下の4種類のマウスを新たに作製し、従来のQC系統マウスと比較しました(図1)。
- 1.QB系統:SV40ポリA配列の代わりに、より強力な「bGHポリA配列」を使用したもの
- 2.QT系統/QI系統:一つの遺伝子から二つのタンパク質をつくる技術[5](T2A配列やIRES配列)を使い、Q神経で発現する内因性の遺伝子と連動させてスイッチタンパク質を働かせるもの
- 3.QD系統:外来のポリA配列を削除し、マウスが本来持っているポリA配列を利用したもの
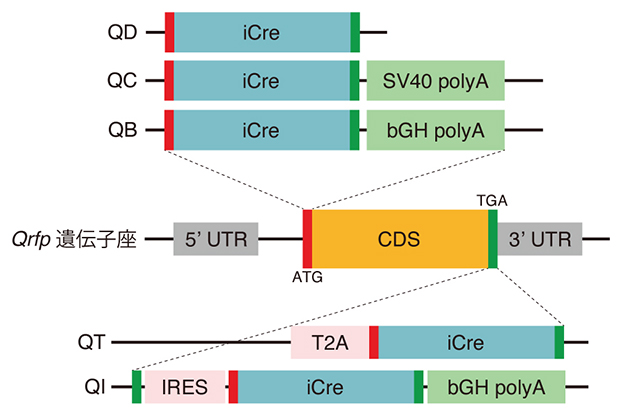
図1 ポリA配列の異なる5種類の遺伝子改変マウス
中央はQ神経で発現するQRFPペプチドをコードするQrfp遺伝子座の模式図で、5'側非翻訳領域(5' UTR)、開始コドン(ATG)、コード領域(CDS)、終止コドン(TGA)、3'側非翻訳領域(3' UTR)を示した。ここにCreリコンビナーゼ(iCre)の遺伝子配列を挿入すると、内在のQrfp遺伝子の発現様式と同様にiCreがQ神経特異的につくられることが期待できる。
上の三つの模式図のうちQBとQCは、Qrfp遺伝子のATGにiCreとポリA配列を挿入したもので、SV40 polyAは先行研究で用いた配列、bGH polyAはSV40よりも強い作用を持つ配列。QDはQCからSV40 polyAを削除したもので、Qrfp遺伝子がもともと持つポリA配列を利用する設計となる。いずれの場合も、転写されたmRNAの翻訳はiCreで終わり、神経ペプチドの一種であるQRFPペプチドは産生されない。
下の二つの模式図(QT、QI)は、Qrfp遺伝子の終止コドンにiCreを挿入したもの。QRFPペプチドの翻訳後にiCreを翻訳するための配列(T2AもしくはIRES)を付加することで、内因性の遺伝子と連動させてスイッチタンパク質を働かせる設計とした。
これらのマウスの脳内で、スイッチがどこに入っているかを蛍光タンパク質で可視化したところ、系統ごとに大きく異なることが明らかになりました(図2)。従来のQC系統(SV40ポリA配列を使用)では、Q神経が存在する領域に限定してきれいにスイッチが入っていました。しかし、遺伝子発現誘導が強力なbGHポリA配列を使用したQB系統では、Q神経以外の広範な脳領域でもスイッチが入ってしまい、特異性が失われていました。その結果、冬眠様状態を誘導しようとしても、代謝の低下が不十分になるなど、正確な制御ができませんでした(図3)。また、QT系統やQI系統では特異性は保たれていましたが、発現量が弱過ぎてスイッチとして機能しませんでした(図2、図3)。一方、マウスが本来持っているポリA配列を用いたQD系統では、ある程度の領域特異性と冬眠様状態の誘導能が回復しました。
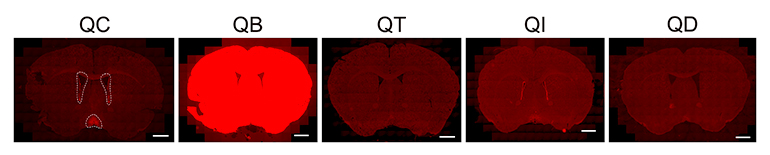
図2 ポリA配列の選択による標的精度の違い
マウス脳の冠状断面図(蛍光写真)。QC系統(SV40使用)では標的部位(前腹側周室核および内側視索前野)に限定した発現(白色破線で囲まれた赤色の蛍光シグナル)が見られるが、QB系統(bGH使用)では脳の広範囲に非特異的な発現が見られる。QT系統やQI系統は動物がもともと有しているQrfp遺伝子を温存しているが、標的部位への発現は弱い。外来のポリA配列を挿入しないQD系統は、発現の特異性は保たれたが、発現量が不十分となった。これらの結果から、ポリA配列の変化のみで、脳における遺伝子発現パターンが大きく変化することが示された。スケールバーは500マイクロメートル(μm、1μmは100万分の1メートル)。
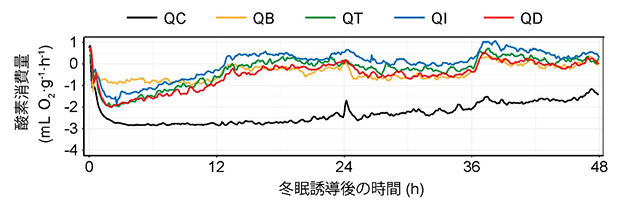
図3 ポリA配列の選択による冬眠様状態の深さの違い
QC系統(SV40使用)では冬眠様状態の誘導後に速やかに酸素消費量が低下し、1日以上の低代謝状態が確認できる。他の4系統では十分な低代謝が見られないが、そのうちQD系統は低代謝状態に至るまでの時間やその程度が比較的に良好な結果を示した。図中の折れ線は各群の平均酸素消費量を表す(QC:16匹、QB:20匹、QT:14匹、QI:20匹、QD:17匹)。
この結果は、「強力なポリA配列」が遺伝子発現を安定させる一方で、その力が強過ぎるために、細胞の種類を見分けるための繊細な制御機構(本来の遺伝子の調節システム)を無視したり、上書きしたりしてしまう可能性を示唆しています。つまり、精密な制御が必要な場面では、あえて「程よい強さ」のパーツや、本来の配列を利用する方が適していることが判明しました。
今後の期待
本研究により、遺伝子工学の「定石」とされていた強力なパーツの使用が、必ずしも最適ではないケースがあることが実証されました。私たちは普段、既存の優れたパーツを組み合わせて実験を行いますが、今回の発見は、パーツ同士の相性を考慮することの重要性を改めて教えてくれています。この知見は、特定の細胞だけをターゲットにする次世代の遺伝子治療ベクター(運び屋)の開発や、ヒトの病態をより正確に再現するモデル動物の作製において、予期せぬ副作用(オフターゲット効果[6])を防ぐための重要な設計指針になると期待されます。
補足説明
- 1.ポリA配列
ポリアデニレーションシグナルともいう。遺伝子の転写(読み取り)を終了させ、メッセンジャーRNA(mRNA)の安定性を高めるために必要なDNA配列。遺伝子組換え技術を用いて外来遺伝子をゲノムに導入し発現させる場合は、既知のポリA配列を付加することで導入遺伝子を効率よく発現させることができる。SV40 polyAやbGH polyAはよく使われるポリA配列の例。 - 2.冬眠様状態(QIH)、Q神経
Q神経は脳(視床下部)の一部に存在する特定の神経細胞で、神経ペプチドの一種であるQRFPを発現する。QIHは、Q神経を人為的に興奮させることで誘導される、冬眠に似た低代謝・低体温状態。QIHはQ neurons-Induced Hypometabolismの略。 - 3.Creリコンビナーゼ
DNAの組換えを行う酵素。特定のDNA配列(loxP配列)に挟まれた領域を切り取ったり反転させたりする機能を持つ。これを利用して、特定の細胞だけで目的の遺伝子をONにする技術が広く使われている。本来は大腸菌に感染するウイルス(バクテリオファージP1)に由来する酵素だが、哺乳類細胞での発現効率を高めたバリエーション(iCre)が一般的に用いられる。 - 4.ノックインマウス
ゲノムの狙った位置に、外来の遺伝子配列を挿入(ノックイン)した遺伝子改変マウス。 - 5.一つの遺伝子から二つのタンパク質をつくる技術
真核細胞のmRNAは、一つのタンパク質の翻訳が終わるとタンパク質合成装置から乖離(かいり)する仕組みを持つため、1本のmRNAに二つ以上のタンパク質情報が載っていても基本的には1種類のタンパク質しか翻訳されない。これに対し、mRNAの途中にリボソームと相互作用する配列(IRES)や、翻訳反応の途中でペプチド結合をスキップさせる配列(T2A)の導入により、真核細胞でも一つの遺伝子から二つのタンパク質をつくらせることが可能となる。 - 6.オフターゲット効果
実験操作が、標的以外の生命機能に影響を及ぼすこと。生命科学研究や創薬研究の方法論の一つは、調べたい遺伝子や生体分子の機能を増強あるいは減衰・喪失させることで、それらの機能の解析や疾患への影響を解明することである。一方、その実験操作が標的以外の生命機能にも影響を及ぼすことがしばしばあり、このため実験の解釈が困難になったり、薬の場合は副作用の原因となったりし得る。
研究チーム
理化学研究所 生命機能科学研究センター
冬眠生物学研究チーム
研究員(研究当時)小野 宏晃(オノ・ヒロアキ)
テクニカルスタッフⅡ 石川 清美(イシカワ・キヨミ)
テクニカルスタッフⅠ 綿木 彩賀(ワタキ・アヤカ)
テクニカルスタッフⅡ 藤野 照子(フジノ・ショウコ)
テクニカルスタッフⅠ 松本 まきや(マツモト・マキヤ)
チームディレクター 砂川 玄志郎(スナガワ・ゲンシロウ)
生体モデル開発チーム
チームディレクター 清成 寛(キヨナリ・ヒロシ)
技師 阿部 高也(アベ・タカヤ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本学術振興会(JSPS)科学研究費助成事業基盤研究(A)「冬眠している組織の低代謝・低体温耐性メカニズムの解明(研究代表者:砂川玄志郎、24H00604)」、同学術変革領域研究(A)「冬眠生物学2.0:能動的低代謝の制御・適応機構の理解(領域代表者:山口良文、23A303)」の研究課題「休眠と冬眠の作動原理の探求(研究代表者:櫻井武、研究分担者:砂川玄志郎、23H04941)」「冬眠研究を支える遺伝子・神経操作技術の創出(研究代表者:清成寛、23H04945)」、同若手研究「細胞内在性RNA編集機構を利用したプログラマブルなRNAスイッチの開発(研究代表者:小野宏晃、23K14130)」、科学技術振興機構(JST)戦略的創造研究推進事業CREST「データ駆動進化医学で解く季節性うつと冬眠の代謝基盤(研究代表者:柚木克之、研究分担者:砂川玄志郎、JPMJCR22N5)」、同創発的研究支援事業FOREST「休眠が惹起する低代謝適応のメカニズムの解明とヒト組織への実装化(研究代表者:砂川玄志郎、JPMJFR2066)」による助成を受けて行われました。
原論文情報
- Hiroaki Ono, Takaya Abe, Kiyomi Ishikawa, Ayaka Wataki, Shoko Fujino, Makiya Matsumoto, Hiroshi Kiyonari, Genshiro A. Sunagawa, "Influence of Poly(A) Sequences and Genetic Elements on iCre Expression and Induction of a Hibernation-Like State in Mice", Journal of Comparative Physiology B, 10.1007/s00360-025-01648-7
発表者
理化学研究所
生命機能科学研究センター 冬眠生物学研究チーム
チームディレクター 砂川 玄志郎(スナガワ・ゲンシロウ)
発表者のコメント
「終わりよければ全てよし」と申しますが、本研究では「DNA配列の終わり(ポリA配列)が悪ければ、全てが良くない」ことを分子レベルで実証しました。DNAに刻まれた情報は、最後の最後まで意味があることを改めて実感しました。また、このような基礎的な研究を、最後までサポートしてくださった、数々の助成事業および関係者の皆さまに深く感謝いたします。(砂川 玄志郎)
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
