理化学研究所(理研)環境資源科学研究センター 植物免疫研究グループの熊倉 直祐 上級研究員、白須 賢 グループディレクター、金沢大学 理工研究域フロンティア工学系/ナノ生命科学研究所(WPI-NanoLSI)の宮澤 佳甫 助教らの国際共同研究グループは、植物病原菌(糸状菌)における膨圧[1]発生に必要な新規遺伝子ペアを発見し、これが新規ポリマーの生合成を通じて感染に必要な膨圧を制御することを明らかにしました。
本研究成果は、細胞における膨圧発生メカニズムの理解を深めるとともに、病原性のみを抑制する低環境負荷型農薬の開発に貢献することが期待されます。
今回、国際共同研究グループは、植物病原糸状菌(カビ)が宿主植物に侵入する際に形成する感染用の細胞「アプレッソリア(付着器)[2]」に着目しました。アプレッソリアは、車のタイヤの空気圧の約40倍にも及ぶ生物界屈指の高い膨圧を生み出し、その力で硬い植物表面を突き破り、感染を可能にします。
国際共同研究グループは、アプレッソリア形成時に遺伝子発現が上昇する機能未知の遺伝子を、独自に開発したゲノム編集技術で破壊し、病原性に寄与する遺伝子のスクリーニングを行いました。その結果、膨圧形成に必須な二次代謝物生合成酵素[3]ペアであるPKS2およびPBG13を同定しました。さらに、PKS2およびPBG13はジヒドロキシヘキサン酸(dihydroxyhexanoic acid:DHHA)[4]をモノマー(単量体)単位とするポリマー(重合体)を生合成することで、アプレッソリアの膨圧形成に寄与することを明らかにしました。
本研究は、科学雑誌『Science』オンライン版(2月12日付:日本時間2月13日)に掲載されます。
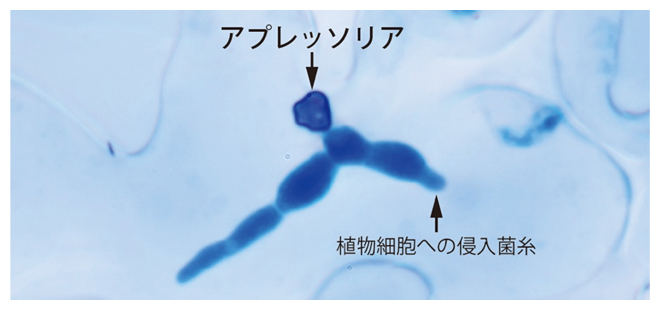
高い膨圧により植物細胞に菌糸を侵入させる植物病原糸状菌のアプレッソリア
背景
アプレッソリアは、炭疽病菌(たんそびょうきん)[5]やイネいもち病菌[5]などの植物病原糸状菌が形成する感染に重要な細胞です。これらの世界の作物に甚大な被害をもたらす糸状菌は、宿主植物表面にアプレッソリアを形成します。アプレッソリアは、生物界屈指の約8メガパスカル(MPa、1MPaは100万パスカル:8MPaは車のタイヤの空気圧の約40倍)に及ぶ高い膨圧を発生させます。
植物細胞の成長や気孔の開閉に使われる膨圧が通常0.3~1MPaであることと比較しても、アプレッソリアの膨圧が高いことが分かります。この膨圧によって、アプレッソリア底部に形成された針状の貫穿糸(かんせんし)[6]が強く押し出され、硬い植物組織の表面を物理的に突き破ることで、感染が成立します。
アプレッソリアは植物表面に付着した胞子から分化し、内部にグリセロールなどの浸透圧調整物質[1]を高濃度に蓄積します。これにより生じた浸透圧[1]によって周囲の水を吸収して高い膨圧を生成します。すなわち、アプレッソリアの細胞壁は、小さな水分子を通す一方で、分子量の大きい浸透圧調整物質は遮断する半透膜[1]として機能します。
これまで、アプレッソリアに特徴的な黒色の色素であるメラニン[7]が細胞壁の半透性に寄与すると考えられてきました。しかしながら近年ではメラニン欠損変異体でも膨圧を形成する例が報告され、未知の因子の存在が示唆されていました。
研究手法と成果
国際共同研究グループはまず、炭疽病菌のアプレッソリア形成時に遺伝子発現が上昇する機能未知の遺伝子を、CRISPR-Cas9を用いたゲノム編集技術[8]によって破壊し、病原性が低下する変異体を探索しました。その結果、感染に必須な二次代謝物生合成酵素をコードするペア遺伝子PKS2およびPBG13を同定しました(図1A)。これらの遺伝子はイネいもち病菌にも機能的に保存されていました。さらに、PKS2およびPBG13の破壊株では、いずれもアプレッソリアから侵入菌糸が形成されず、この遺伝子ペアがアプレッソリア機能に必須であることが明らかとなりました(図1B)。
そこで、アプレッソリアにおける膨圧を異なる手法で検証しました。浸透圧の原理を利用した手法と、原子間力顕微鏡(AFM)[9]を用いた硬さの計測[9]のいずれにおいても、PKS2とPBG13の遺伝子を破壊した変異体(以降pks2およびpbg13変異体と表記)で膨圧が低下していることが示されました(図1C)。
次に、PKS2とPBG13がどのように膨圧に寄与しているのかを検証しました。アプレッソリアにおいて半透膜として機能する細胞壁について、さまざまな分子量を持つ浸透圧調整物質の透過性を指標として孔(あな)サイズを評価しました。その結果、野生型では分子量約140以上の分子を通さず0.4~1.7ナノメートル(nm、1nmは10億分の1メートル)程度と推定されたのに対し、pks2およびpbg13変異体では分子量が10,000の分子も透過させ5nm以上と推定されました(図1D)。すなわち、PKS2およびPBG13は半透膜として機能する細胞壁の孔サイズを縮小し、分子量の大きい浸透圧調整物質が透過するのを止める役割を担っていることが示されました。
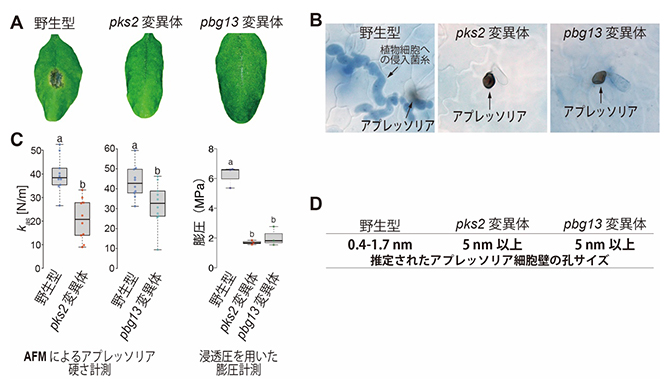
図1 アプレッソリアの細胞壁孔サイズを制御するPKS2およびPBG13の同定
- A.PKS2およびPBG13は炭疽病菌の感染に必須である。野生型炭疽病菌は植物葉上で黒色の病斑(びょうはん)を形成したが、pks2およびpbg13変異体では病斑が認められなかった。
- B.PKS2およびPBG13はアプレッソリアからの植物細胞侵入に必要である。野生型炭疽病菌では、アプレッソリアから植物細胞内へ伸長した侵入菌糸が観察されたが、pks2およびpbg13変異体では観察されなかった。
- C.PKS2およびPBG13はアプレッソリアにおける膨圧形成に寄与する。左:原子間力顕微鏡(AFM)によるアプレッソリアの硬さの計測結果。pks2およびpbg13変異体では、野生型と比較してアプレッソリアの硬さが有意に低下した。kas (N/m)は、AFMで測定したアプレッソリア表面の硬さを表す指標であり、この値が大きいほど硬いことを示す。右:浸透圧の原理を用いた膨圧計測法においても、pks2およびpbg13変異体では、野生型に比べて膨圧が有意に低下していた。
- D.PKS2およびPBG13は半透膜として機能するアプレッソリア細胞壁の孔サイズ縮小に寄与する。分子サイズの異なる溶質の透過性を指標として、細胞壁孔サイズを推定した結果、pks2およびpbg13変異体では野生型に比べて細胞壁の孔サイズが大きくなっていることが示された。
PKS2およびPBG13の遺伝子について、経時的な発現変化をリアルタイムPCR[10]で解析したところ、両遺伝子はアプレッソリアの細胞壁が形成されるタイミングで発現のピークを示しました(図2A)。さらに、PKS2とPBG13それぞれを蛍光タンパク質[11]と融合させたライブセルイメージング(生細胞イメージング)により、両タンパク質がアプレッソリアの細胞質に局在することが明らかとなりました(図2B)。これらの結果は、PKS2およびPBG13が細胞壁形成の初期段階において、何らかの二次代謝物を生合成することで、細胞壁の孔サイズ縮小に寄与することを示唆しています。
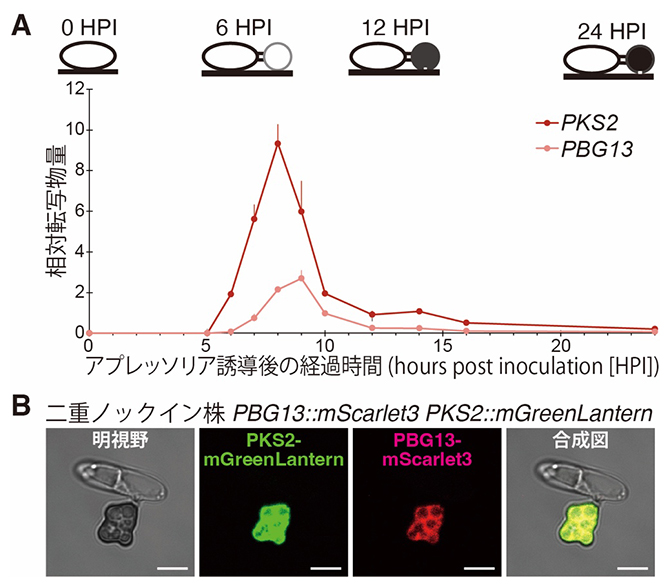
図2 アプレッソリア形成時に発現ピークを迎え、細胞質に局在するPKS2およびPBG13
- A.PKS2およびPBG13転写物の経時的リアルタイムPCR解析。PKS2およびPBG13はアプレッソリア誘導後約8~9時間で発現ピークを迎えた。
- B.炭疽病菌アプレッソリアにおけるPKS2およびPBG13の局在。PKS2-mGreenLanternおよびPBG13-mScarlet3を共焦点蛍光顕微鏡で観察した結果、両タンパク質はいずれも細胞質に局在していた。本解析には、PKS2およびPBG13のコード配列の終止コドン(タンパク質合成の終了を示す塩基3個の配列)直前に、それぞれmGreenLanternとmScarlet3の蛍光タンパク質をノックイン(導入)した二重ノックイン株を用いた。
そこで、PKS2とPBG13が生合成する二次代謝物の解析を行いました。イネいもち病菌の菌糸細胞においてPKS2およびPBG13の遺伝子を発現させたところ、分子量130刻みの化合物ピークが検出され、分子量130のモノマー単位から成るポリマーが生合成されていることが示されました(図3A)。さらに、高分解能質量分析[12]およびNMR[12]解析により、このモノマーがジヒドロキシヘキサン酸(DHHA)で、それがエステル結合[13]したポリマーを生成していることが明らかとなりました(図3B)。
最後に、実際のアプレッソリアにおいてDHHAが生合成されているかを検証しました。その結果、高密度誘導が可能なアブラナ科炭疽病菌のアプレッソリアからDHHAが検出されました(図3C)。さらに、炭疽病菌のアプレッソリアから精製したPKS2とPBG13の生化学反応系からもDHHAが検出され、PKS2およびPBG13がDHHAの生合成に必要・十分であることが明らかとなりました(図3D)。
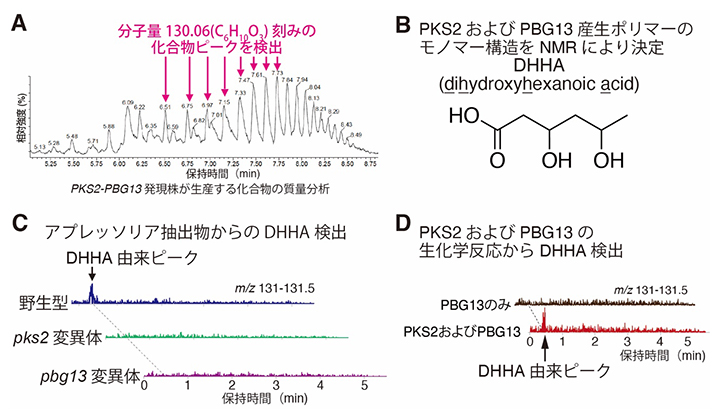
図3 PKS2およびPBG13はDHHAをモノマーとするポリマーを生合成
- A.PKS2およびPBG13を菌糸で異所発現させたイネいもち病菌において、分子量130刻みの化合物ピークが検出された。PKS2およびPBG13発現株がC6H10O3(分子量: 130)をモノマー単位とするポリマーを生合成することが示された。
- B.高分解能質量分析およびNMR解析により、PKS2およびPBG13産生ポリマーのモノマー構造を決定した。PKS2およびPBG13は、DHHAモノマーがエステル結合したポリマーを生合成することが明らかとなった。
- C.炭疽病菌アプレッソリアからDHHAを検出した。In vitro(試験管内)条件下で高密度誘導したアブラナ科炭疽病菌野生型のアプレッソリア抽出物からDHHAが検出された一方、pks2およびpbg13変異体からは検出されなかった。m/z:質量電荷比で、分子量を表す。
- D.PKS2およびPBG13の生化学反応により、DHHAが生合成された。
以上の結果から、PKS2およびPBG13が生合成するDHHAポリマーは、アプレッソリア細胞壁の孔サイズを縮小させることで浸透圧調整物質の流出を防ぎ、その結果として高い浸透圧および膨圧の形成に寄与すると考えられます(図4A)。
DHHAポリマーがどのような分子機構によって細胞壁の孔サイズを縮小するかは今後の課題ですが、DHHAポリマーが細胞壁の構成要素(キチン、グルカン、メラニンなど)と相互作用することで、細胞壁の間隙を狭めている可能性が考えられます(図4B)。
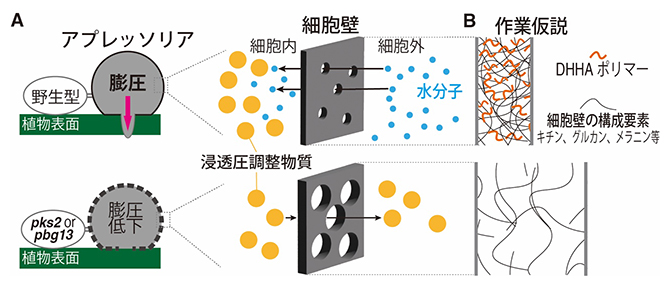
図4 PKS2、PBG13が生合成するDHHAポリマーによるアプレッソリア膨圧制御モデル
- A.アプレッソリアは、PKS2およびPBG13によって生合成されるDHHAポリマーにより、細胞壁の孔サイズを縮小することで、高い膨圧を発生させる。
- B.DHHAポリマーの作用モデル。キチン、グルカンなどを主な成分とするスポンジ状構造の細胞壁において、DHHAポリマーが細胞壁成分と相互作用することで狭め、半透性を高めるモデル。
今後の期待
本研究では、炭疽病菌やイネいもち病菌において、感染時に必要な高い膨圧発生を担う遺伝子ペアを発見し、その機能を明らかにしました。これにより、これまでブラックボックスであった生物界屈指の膨圧発生メカニズムの一端が、分子レベルで理解できるようになりました。
今後は、DHHAポリマーが細胞壁内でどのような分子と結合し、どのように機能しているのかを明らかにすることで、膨圧発生の全体像の解明を目指します。こうした基礎的な知見は、植物病原糸状菌が作物に侵入する仕組みを理解し、制御するための基盤となります。
炭疽病菌やイネいもち病菌は世界中の主要作物に甚大な被害を与えています。PKS2およびPBG13を標的とする阻害剤は、菌を殺すのではなく病原性のみを抑制することが期待できるため、耐性菌の出現や環境負荷を抑えた新しい病害制御技術につながります。
さらに、アプレッソリアの細胞壁は、高い膨圧に耐える物理的強度を備えた半透膜として機能します。半透膜構造の知見とDHHAポリマーは、機能性バイオマテリアルの設計や創製への応用が期待されます。
本研究成果は、国際連合が定めた17の目標「持続可能な開発目標(SDGs)[14]」のうち、「2. 飢餓をゼロに」および「15. 陸の豊かさも守ろう」に貢献するものです。
補足説明
- 1.膨圧、浸透圧調整物質、浸透圧、半透膜
半透膜は水分子を通す一方で、一定のサイズ以上の溶質を通さない小さな孔を持つ膜のこと。半透膜で隔てられた二つの水溶液の間では、溶質濃度の差によって水分子が濃度の高い側へ移動しようとする力が働き、これを浸透圧と呼ぶ。半透膜を透過できない溶質は浸透圧調整物質と呼ばれ、濃度差が大きいほど浸透圧が高くなる。水中で形成されるアプレッソリア([2]参照)では、細胞壁が半透膜として機能し、その内部に浸透圧調整物質を高濃度に蓄えることで大きな浸透圧が発生する。その結果発生するアプレッソリア内部の水圧が膨圧となり、硬い植物表面への侵入を可能にする。 - 2.アプレッソリア(付着器)
糸状菌が形成する主に感染の専門細胞。19世紀後半にドイツで炭疽病菌([5]参照)の顕微鏡観察により発見・命名された。付着する・押し付けるという意味を持つラテン語に由来するappressorium(複数形appressoria)と名付けられ、付着器と訳される。植物病原糸状菌においては、炭疽病菌やイネいもち病菌([5]参照)が、宿主植物への侵入に用いることがよく知られている。植物組織に強く接着し、高い膨圧を利用して植物組織を突き破ることで、侵入を成立させる。 - 3.二次代謝物生合成酵素
直接の生存には必須ではないものの、環境への適応や生物間相互作用を助ける二次代謝物の生合成に寄与する酵素の総称であり、細菌、糸状菌、植物などに特有である。二次代謝物の一種であるポリケタイドを合成するポリケタイド合成酵素(PKS)をはじめ、二次代謝物の構造や反応様式に応じて多様な種類が知られている。本研究で同定したPKS2およびPBG13はいずれも、ポリケタイド生合成に関与する二次代謝物生合成酵素である。 - 4.ジヒドロキシヘキサン酸(dihydroxyhexanoic acid:DHHA)
炭素分子6個から成る炭素鎖にカルボキシ基(―COOH)と二つのヒドロキシ基(―OH)を持つ有機酸である。化学式はC6H12O4、構造式は図3Bに記載。本研究では、この分子がエステル結合で連結(各連結でH2O 1分子が外れる)したポリマーが、細胞壁の性質を変化させる性質を持つことが示された。 - 5.炭疽病菌(たんそびょうきん)、イネいもち病菌
いずれも作物被害をもたらす植物病原糸状菌である。炭疽病菌(Colletotrichum属菌)は現時点で260種以上が報告され、世界中のほぼすべての作物から被害が確認されている。日本では特にイチゴに被害を与える病原菌としてよく知られている。なお、家畜やヒトに感染する細菌の炭疽菌(Bacillus anthracis)とは完全に別種である。イネいもち病菌(Pyricularia oryzae/Magnaporthe oryzae)はイネに甚大な被害を与える植物病原糸状菌で世界的に最も重要な病害の一つとされている。近年ではコムギへの感染も報告され、アフリカや南米を中心に被害が拡大している。 - 6.貫穿糸(かんせんし)
アプレッソリア底部から植物細胞内へ向けて形成される針状の菌糸構造(penetration peg)。 - 7.メラニン
黒色の色素の総称。アプレッソリアにおいては、1,8-dihydroxynaphthalene(1,8-DHN)を前駆体とする黒色色素がメラニンと総称されている。しかしながら、1,8-DHN由来ポリマーはアプレッソリア細胞壁で他の成分と結合することが示唆されており、メラニンの化学的実態や構造については、いまだ解明の途上にある。 - 8.CRISPR-Cas9を用いたゲノム編集技術
CRISPR-Cas9は、狙った遺伝子配列を正確に切断することで、遺伝子を改変することができるゲノム編集技術である。DNA切断活性を持つCas9タンパク質と、標的DNA配列と相同な配列を持つガイドRNA(gRNA)から構成される。Cas9とgRNAの複合体が、gRNAと相同な配列を持つ二本鎖DNAを特異的に切断する。本研究では、CRISPR-Cas9によってゲノムDNAを切断し、細胞が持つ修復機構である「相同組換え」を誘導して、遺伝子破壊や蛍光タグのノックインなどのゲノム編集を行った。 - 9.原子間力顕微鏡(AFM)、硬さの計測
原子間力顕微鏡は、微細な探針(プローブ)で観察対象を走査し、探針のたわみや対象との接触位置の変化から、表面の硬さや凹凸などの物理学的情報を計測する顕微鏡のことである。本研究では、直径数マイクロメートル程度のアプレッソリアの「硬さ」を計測した。硬さは、使用した探針の性質と、一定の力で押したときの探針のたわみ量から硬さが定量的に評価される。AFMはatomic force microscopyの略。 - 10.リアルタイムPCR
DNA配列を1反応ごとに約2倍に増幅するポリメラーゼ連鎖反応の原理を利用し、反応の進行に伴って増加するDNA量をリアルタイムで定量する手法である。あらかじめmRNAを鋳型としてDNAに変換しておくことで、各サンプル中の転写物(遺伝子発現量)を相対的に比較・定量することができる。PCRはpolymerase chain reactionの略。 - 11.蛍光タンパク質
一定の波長の光を当てると蛍光を発するタンパク質の総称。細胞内で、着目したタンパク質と蛍光タンパク質を融合した状態で発現させ、蛍光顕微鏡で観察することで、細胞内での局在や動態を観察することができる。本研究では、PKS2とPBG13にそれぞれmGreenLanternおよびmScarlet3という異なる波長の蛍光を発するタンパク質を融合させることで、これら二つのタンパク質の発現と局在を同時に観察した。 - 12.高分解能質量分析、NMR
高分解能質量分析は、化合物の質量を小数点以下の高い精度で計測する手法であり、炭素・水素・酸素から成る有機化合物の場合には、化学式を一意に決定することができる。NMR(核磁気共鳴)は、分子内の原子の結合状態や配置を解析することで、化合物の構造式を決定する手法である。本研究では、これら二つの手法を組み合わせることで、dihydroxyhexanoic acid(DHHA)の化学構造を決定した。NMRはnuclear magnetic resonanceの略。 - 13.エステル結合
酸(―COOH:カルボキシル基)とアルコール(―OH: ヒドロキシ基)が反応することで生じる化学結合であり、この反応により水分子(H2O)が一つ外れて―COO―という結合が形成される。DHHAは、カルボキシル基とヒドロキシ基の両方を持つため、これらが互いに結合することでポリマーを形成する。 - 14.持続可能な開発目標(SDGs)
2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標。持続可能な世界を実現するための17の目標、169のターゲットから構成され、発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる(外務省のホームページから一部改変して転載)。
国際共同研究グループ
理化学研究所 環境資源科学研究センター
植物免疫研究グループ
グループディレクター 白須 賢(シラス・ケン)
上級研究員 熊倉 直祐(クマクラ・ナオヨシ)
専任研究員 本山 高幸(モトヤマ・タカユキ)
研究員 石濱 伸明(イシハマ・ノブアキ)
研究員(研究当時)パメラ・ガン(Pamela Gan)
研修生 米原 克磨(ヨネハラ・カツマ)
分子構造解析ユニット
ユニットリーダー 越野 広雪(コシノ・ヒロユキ)
技師 野川 俊彦(ノガワ・トシヒコ)
質量分析・顕微鏡解析ユニット
上級技師 豊岡 公徳(トヨオカ・キミノリ)
技師 佐藤 繭子(サトウ・マユコ)
テクニカルスタッフⅡ 後藤 友美(ゴトウ・ユウミ)
金沢大学
ナノ生命科学研究所
所長/教授 福間 剛士(フクマ・タケシ)
理工研究域フロンティア工学系/ナノ生命科学研究所
助教 宮澤 佳甫(ミヤザワ・ケイスケ)
大学院自然科学研究科 フロンティア工学専攻
修士課程学生(研究当時)松森 海晴(マツモリ・カイセイ)
パリ=サクレー大学/フランス国立農業・食糧・環境研究所(INRAE)
研究ディレクター リチャード・オコネル(Richard O'Connell)
研究員 ジュリアン・ペルニエ(Julien Pernier)
顕微鏡プラットフォーム運用責任者 坂井 香織(サカイ・カオリ)
パリ=サクレー大学/フランス国立科学研究センター(CNRS)
研究ディレクター サンドリーン・レベック=フォート(Sandrine Lévêque-Fort)
研究支援
本研究は科学技術振興機構(JST)戦略的創造研究推進事業さきがけ「アプレッソリアを遊ぶ:生物界屈指の膨圧・接着力制御(研究代表者:熊倉直祐、JPMJPR24O5)」、同ACT-X「遺伝子多重破壊法を用いた感染メカニズムの網羅的解明(研究代表者:熊倉直祐、JPMJAX20B4)」、同ACT-X「生物の表面と内部を可視化する超解像液中AFM(研究代表者:宮澤佳甫、JPMJAX20BH)」、同革新的GX技術創出事業「GXを駆動する微生物・植物「相互作用育種」の基盤構築(研究代表者:野村暢彦、主たる共同研究者:白須賢、JPMJGX23B2)」、日本学術振興会(JSPS)科学研究費助成事業国際共同研究加速基金(国際共同研究強化(A))「ケミカルバイオロジーを用いた植物病原糸状菌のEV分泌機構の解明(研究代表者:熊倉直祐、協力者:Richard O'Connell、JP19KK0397)」、同若手研究「植物病原糸状菌の病原性に寄与する二次代謝物の同定と機能解明(研究代表者:熊倉直祐、JP20K15500)」、理化学研究所基礎科学特別研究員制度「糸状菌の病原性を指標にした「獲得形質の遺伝」メカニズムの解明(研究代表者:熊倉直祐)」、RIKEN Incentive Research Project 「Structural analysis of the PKS2-PBG13 biochemical reaction essential for turgor generation in plant-pathogenic fungi: towards novel disease control strategies(研究代表者:熊倉直祐)」「Establishment of biochemical reaction system and inhibitor screening of a pair of secondary metabolite-related enzymes that are essential for infection of plant pathogenic fungi(研究代表者:熊倉直祐、分担者:本山高幸)」、金沢大学ナノ生命科学研究所Bio-SPM技術共同研究事業「植物病原糸状菌付着器の高い膨圧発生を可能にする細胞壁の解析(研究代表者:熊倉直祐、受入研究者:宮澤佳甫)」、JSPS科学研究費助成事業基盤研究(C)「植物病原糸状菌感染に寄与する非リボソームペプチド合成酵素の生産物同定と機能解明(研究代表者:熊倉直祐、JP23K05158)」「「共生糸状菌」からの二次代謝産物発掘および生物間相互作用における役割の解明(研究代表者:本山高幸、JP20K05820)」、同若手研究「ケミカルジェネティクスを用いた植物病原糸状菌のエフェクター分泌機構の解明(研究代表者:熊倉直祐、JP18K14440)」、同特別研究員奨励費「植物病原糸状菌の感染段階移行時に宿主細胞死が引き起こされるメカニズムの解明(研究代表者:米原克磨、JP24KJ0633)」、同学術変革領域研究(学術研究支援基盤形成)「先端バイオイメージング支援プラットフォーム(研究分担者:豊岡公徳、JP22H04926)」、同基盤研究(A)「アポプラストにおける植物-病原体相互作用(研究代表者:白須賢、JP22H00364)」、同学術変革領域研究(A)「不均一土壌環境に応答した寄生植物の感染統御機構(研究分担者:白須賢、JP20H05909)」、文部科学省世界トップレベル研究拠点プログラム(WPI)(金沢大学ナノ生命科学研究所)、理化学研究所TRIPイニシアチブによる助成、ならびに理化学研究所環境資源科学研究センター質量分析・顕微鏡ユニットおよび分子構造解析ユニットの支援を受けて行われました。
原論文情報
- Naoyoshi Kumakura*, Takayuki Motoyama, Keisuke Miyazawa, Toshihiko Nogawa, Julien Pernier, Katsuma Yonehara, Mayuko Sato, Yumi Goto, Kaori Sakai, Nobuaki Ishihama, Kaisei Matsumori, Pamela Gan, Kiminori Toyooka, Sandrine Lévêque-Fort, Hiroyuki Koshino, Takeshi Fukuma, Richard J. O'Connell, Ken Shirasu* *責任著者, "Dihydroxyhexanoic acid biosynthesis controls turgor in pathogenic fungi", Science, 10.1126/science.aec9443
発表者
理化学研究所
環境資源科学研究センター 植物免疫研究グループ
上級研究員 熊倉 直祐(クマクラ・ナオヨシ)
グループディレクター 白須 賢(シラス・ケン)
金沢大学 理工研究域フロンティア工学系/ナノ生命科学研究所(WPI-NanoLSI)
助教 宮澤 佳甫(ミヤザワ・ケイスケ)
 左から熊倉直祐、白須賢
左から熊倉直祐、白須賢
 宮澤 佳甫
宮澤 佳甫
発表者のコメント
炭疽病菌で独自に開発したゲノム編集技術によりPKS2およびPBG13を同定しました。これを起点として、アプレッソリア解析のための技術開発と並行しながら、研究拠点である横浜からフランス、金沢、和光へと要素技術を持つ共同研究者を訪ね、共同研究を一つずつ積み重ねてきました。各拠点を繰り返し訪問して試行錯誤や議論を重ねる中で、当初は断片的であったデータから、「PKS2・PBG13が生合成するDHHAポリマーによって細胞壁の孔サイズが縮小され、その結果としてアプレッソリアの膨圧が発生する」という一つのストーリーが立ち上がってきたときの驚きは、今も忘れることができません。研究過程では、思わぬ逆風にさらされることも度々ありましたが、素晴らしい共同研究者との協働により、本発表に至りました。細胞の持つ深奥のごく一端を見いだしたときの驚きを、少しでも共有できれば幸いです。(熊倉 直祐)
炭疽病菌のゲノム配列決定からスタートし、約15年にわたって積み重ねてきた研究の成果です。本研究は、ゲノム解析の重要性を改めて示すとともに、これまでの定説を覆す重要な発見につながりました。ゲノムを読み解くことで、「未知であることすら未知であった」現象や仕組みが明らかになる可能性を、あらためて実感させてくれる成果だと感じています。さらに、物質を特定する生化学的な研究の重要性も再認識しました。ゲノム解析と生化学を組み合わせることで、新たなブレイクスルーが生まれることを示した好例だと思います。(白須 賢)
原子間力顕微鏡(AFM)を用いて、アプレッソリアの硬さを定量的に計測することに成功しました。本研究は約3年前にスタートし、当初は熊倉先生に毎週金沢までお越しいただきながらアプレッソリアのAFM計測に特化した細胞培養方法の確立とAFM計測技術の開発に取り組んできました。AFM実験中に、2人で計測画面をのぞき込みながら何時間も議論を重ね、試行錯誤の末にScience誌に掲載されるようなデータの取得に至ったことは研究者として最高の思い出です。本成果は、これまで応用が限られていた微生物分野におけるAFMの新たな可能性を示すものであり、AFMを用いた物理学的な計測手法が今後の微生物分野の発展に大きく寄与することが期待されます。(宮澤 佳甫)
JST事業に関する問い合わせ
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
沖代美保(オキシロ・ミホ)
Tel: 03-3512-3524
Email: presto@jst.go.jp
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
金沢大学 ナノ生命科学研究所 事務室
Tel: 076-234-4555
Email: nanolsi-office@adm.kanazawa-u.ac.jp
科学技術振興機構 広報課
Tel: 03-5214-8404
Email: jstkoho@jst.go.jp
