理化学研究所(理研)生命医科学研究センター 空間免疫制御理研ECL研究ユニットの佐藤 尚子 理研ECL研究ユニットリーダー(開拓研究所 佐藤空間免疫制御理研ECL研究ユニット 理研ECL研究ユニットリーダー)、脳神経科学研究センター 動物資源開発支援ユニットの重野 佑布子 技師らの共同研究グループは、胃の特定の共生細菌が免疫応答を介してピロリ菌感染から胃を守る仕組みを発見しました。
本研究成果は、これまで貯蔵・殺菌臓器として考えられてきた胃の免疫の仕組みの理解につながり、ピロリ菌感染から胃を守る共生細菌の存在についての新しい発見です。また、胃がんや胃炎に移行する可能性が高いピロリ菌感染から胃を守る共生細菌の存在が明らかになったことにより、胃の病気を防ぐ今後の基礎的な知見として、最終的にはヨーグルトなどに入れて摂取することで予防の可能性につながることが期待されます。
今回、共同研究グループは、胃に存在する共生細菌(常在細菌)が産生する代謝物が胃の線維芽細胞[1]に特異的に働きかけ、刺激を受けた線維芽細胞が自然リンパ球(ILCs)[2]のサブセットである2型自然リンパ球(ILC2)[2]を活性化することで胃の組織防御が増強されるメカニズムを発見しました。このメカニズムの発見により、共生細菌と免疫細胞の連携を通じて胃粘膜を守る仕組みを制御していることを明らかにしました。
本研究は、科学雑誌『Mucosal Immunology』オンライン版(2月5日付)に掲載されました。
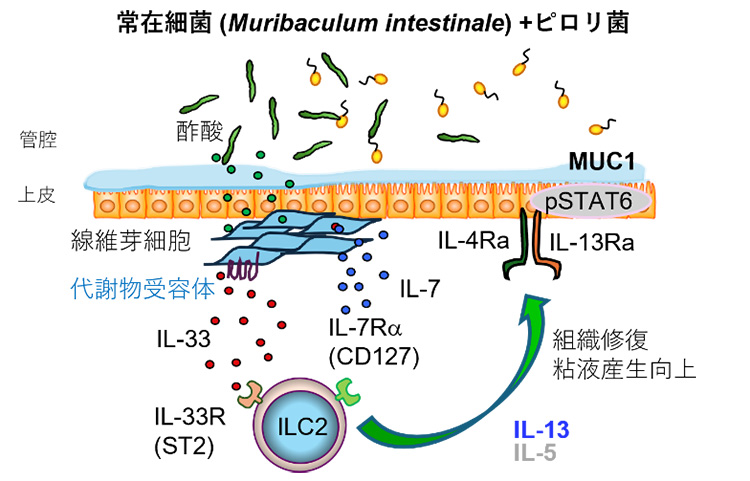
共生細菌(YL27: Muribaculum intestinale)が胃で組織防御に働くメカニズム図
背景
私たちの体の粘膜は、外界から侵入する病原体を防ぐ重要な防御ラインであり、腸や肺では共生細菌が免疫機能を調節していることが広く知られています。しかし、強い酸性環境を持つ胃は長年「細菌がほとんど存在しない臓器」と考えられてきたため、免疫と共生細菌の関係についての研究はほとんど進んでいませんでした。1980年代にピロリ菌が発見されて以降、胃の免疫研究は主に胃がんに焦点が当てられてきました。一方で、胃がどのようにして過剰な炎症を抑えながら粘膜を守っているのか、特に共生細菌との関係性や共生細菌そのものによる免疫応答への影響の仕組みは十分に解明されていませんでした。
近年の研究により、胃にも少数ながら共生細菌が存在することが分かってきましたが、その機能的な役割は不明なままでした。また、胃を免疫臓器と捉えて免疫応答を解析している報告が限られており、胃特有の細菌叢(さいきんそう)と誘導される免疫制御機構を明らかにすることは、長年の課題とされてきました。
こうした背景の下、共同研究グループは、胃に定着する特定の常在細菌が、病原菌とは異なる形で免疫応答を調節し、胃粘膜の恒常性維持に関与しているのではないかと考え、本研究に取り組みました。
研究手法と成果
共同研究グループはまず、佐藤ユニットリーダーらが以前報告した、胃の2型自然リンパ球(ILC2)を誘導する可能性がある菌のS24-7科菌[3] 注)にターゲットを絞り、共生細菌の単離を試みました(図1)。
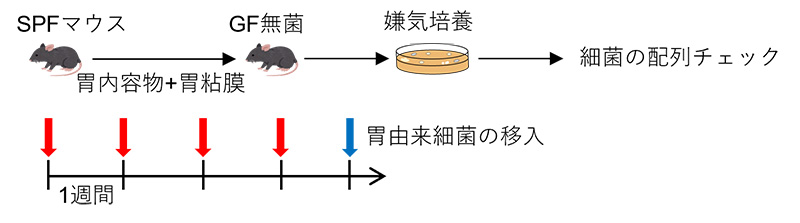
図1 胃から単離した共生細菌を同定した方法
共生細菌が存在するマウス(SPFマウス)から胃内容物および胃粘膜層を回収し、残餌(ざんじ)や組織を取り除いた後、無菌マウスに経口により4回投与することで胃由来細菌を無菌マウスに定着させた。SPFマウス由来の菌を定着させてマウスの胃から胃内容物と胃粘膜層を回収し嫌気性培養を実施。得られたコロニーの配列を確認することで菌種を特定した。
マウスの胃に常在する共生細菌を単離することに成功し、次にS24-7科に属する菌であるS86とYL27を使い、その菌だけを持つマウス(ノトバイオートマウス)を作製しました。その上で、このノトバイオートマウスの胃における免疫応答解析を行いました。胃は強い酸性環境を持つため、細菌の定着や免疫応答の解析が難しい臓器ですが、本研究では単離した細菌の全ゲノム配列を解析し、胃でも共生することができる機能について推測することを試みました。その結果、共同研究グループは、S86はウレアーゼ[4]を産生せず、一方、YL27はウレアーゼをコードする配列を持ちタンパク質として産生することで胃酸を中和して胃に定着することを確認しました(図2)。
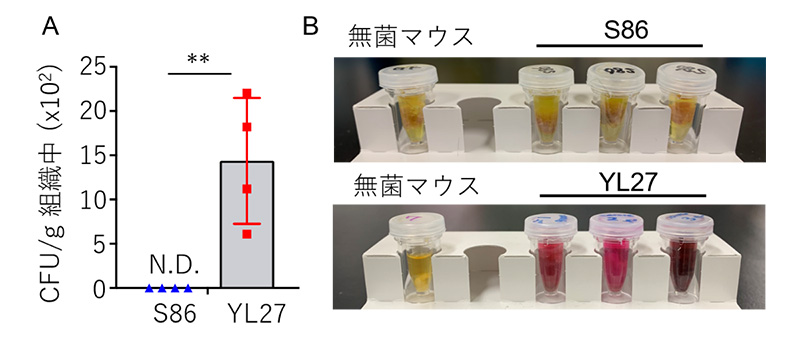
図2 S24-7科菌であるS86、YL27の胃への定着確認
- A.それぞれのノトバイオートマウスの胃に生息する菌数。CFUはColony Forming Unitの略で菌が生きて増殖できる数を示す。**:有意水準1%での有意差あり。N.D.:not detected(未検出)。
- B.ノトバイオートマウスの胃におけるウレアーゼ活性確認。ピンク色になるとウレアーゼ活性を持つ(酵素基質反応による確認)。S86ノトバイオートマウスではウレアーゼ活性を持たないため黄色のまま。YL27ノトバイオートマウスは基質が入った溶液がピンク色に変わり、ウレアーゼの活性が確認された。
YL27が胃で定着することを確認したので、このYL27を定着させたノトバイオートマウスを使い、単一細胞RNA解析[5]やフローサイトメトリー解析[6]などの免疫学的手法を組み合わせ、胃組織を構成する多様な細胞の遺伝子発現や機能を網羅的に解析しました。その結果、胃の線維芽細胞が、共生細菌由来の代謝物を感知してILC2を活性化させるサイトカイン[7]IL-33を大量に産生することを突き止めました(図3)。
さらに、このIL-33によってILC2からのIL-13産生が誘導され、胃上皮に発現しているIL-13受容体を介して粘膜防御機能を高めることが明らかになりました(図3)。この仕組みにより、胃は過剰な炎症を起こすことなく、防御機能を維持していると考えられます。また、ピロリ菌感染モデルを用いた解析から、この共生細菌によって誘導される免疫応答が、ピロリ菌の胃内定着を抑制し、胃粘膜を保護することも示されました。本研究は、胃の免疫が病原菌への反応だけでなく、常在細菌との相互作用によって精密に制御されていることを示す新たな知見です。
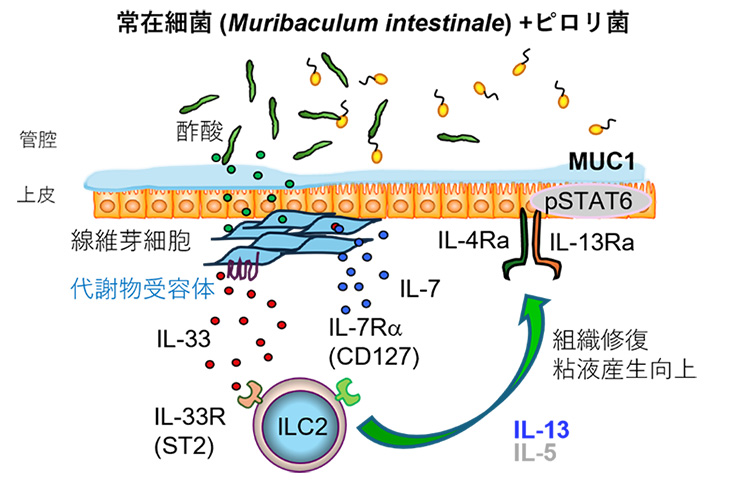
図3 共生細菌由来の代謝物を介したILC2の活性化のメカニズム
YL27を定着させたノトバイオートマウスの胃組織を構成する多様な細胞の遺伝子発現や機能を網羅的に解析した結果、胃の線維芽細胞が、共生細菌由来の代謝物を感知してILC2を活性化させるIL-33を大量に産生させた。このIL-33は、ILC2からのIL-13産生を誘導し、このIL-13を介して胃上皮に働きかけ、粘膜防御機能を高めていた。
注)Satoh-Takayama N. et al, Bacteria-Induced Group 2 Innate Lymphoid Cells in the Stomach Provide Immune Protection through Induction of IgA. Immunity, 2020.
今後の期待
本研究の新規性は、これまでほとんど注目されてこなかった「胃に常在する細菌」が、免疫細胞だけでなく線維芽細胞を介して免疫応答を制御し、胃粘膜を守っていることを明らかにした点にあります。胃の免疫は病原菌への反応が中心と考えられてきましたが、本研究は、共生細菌との共存によって胃の防御機構が能動的に維持され、ピロリ菌感染からの防御に働くことを示しました。
この発見により、胃の健康を「病原菌を排除する」という発想だけでなく、「共生細菌と免疫のバランスを整える」という新しい視点で捉えることが可能になります。将来的には、胃の免疫状態を調節することで、ピロリ菌感染による胃炎や粘膜障害の進行を抑えるといった、新たな予防・管理戦略につながる可能性があります。本研究は、胃が単に殺菌・貯蔵を行う臓器ではなく、共生細菌と免疫が協調して働く「生きた防御システム」であるということをより強める科学的エビデンスの一つになります。
応用研究として、今回明らかになった免疫制御経路を基に、将来的にはヨーグルトや健康補助食品として YL27を摂取することで、胃の免疫機能を穏やかに調節する新しい介入法の検討が可能になると考えられます。具体的な医療応用や実用化にはさらなる検証が必要であり、数年から十年程度の基礎・応用研究の積み重ねが不可欠ですが、本研究はその第一歩となる成果です。
補足説明
- 1.線維芽細胞
結合組織を構成する主要な細胞で、コラーゲンなどの細胞外マトリックスや増殖因子を大量に分泌するなどの機能がある。近年は構造を支える細胞としての役割に加え、免疫応答や炎症の調節に関わることが分かってきている。 - 2.自然リンパ球(ILCs)、2型自然リンパ球(ILC2)
自然リンパ球(Innate lymphoid cells: ILCs)はリンパ球系に属する免疫細胞でありヘルパーT細胞と機能的に類似している。このILCには1型から3型までの大きく分けて3種のサブセットが存在し、それぞれ役割が異なる。特に2型自然リンパ球(ILC2)は、IL-33やIL-25により活性化してIL-5やIL-13を産生する。アレルギーの誘導や寄生虫感染排除に重要であるだけでなく、近年は代謝や神経とも深い関係があることが知られている。 - 3.S24-7科菌
バクテロイデス目に属する細菌。細菌叢特異的に持つ配列をターゲットとした16S rRNA解析を基にS24-7と命名されたが、2019年のメタゲノム解析および分離培養法を含んだ包括的解析以降、Muribaculaceaeと命名されている。ヒトを含む恒温動物の消化管に多く存在する。網羅的細菌叢解析により、炎症性腸疾患や肥満、2型糖尿病などの慢性疾患で大きく増減することが報告されており、疾患との関係性が示唆されるものの、菌そのものの役割や免疫応答への作用・影響についてこれまで報告はなかった。 - 4.ウレアーゼ
尿素(Urea)を分解してアンモニア(NH3)と二酸化炭素(CO2)を生成する酵素。強いアルカリ性を持つため、酸を中和する。 - 5.単一細胞RNA解析
1細胞中に含まれるRNAを、ハイスループットDNAシーケンサーを用いて解読(塩基配列決定)し、網羅的かつ定量的にその量や種類を決定する方法。 - 6.フローサイトメトリー解析
細胞の蛍光や散乱光を検出して分析する技術。この技術を用いて、細胞のサイズや構造、表面や内部の分子の発現を1細胞レベルで調べることができる。 - 7.サイトカイン
免疫細胞や実質細胞などから産生され、免疫細胞の活性化や抑制化を誘導することで炎症を引き起こし、調節する液性因子。IL-33は主に上皮細胞などが産生するサイトカインで、細胞障害を引き起こすことや免疫応答を活性化する機能があることが知られている。
共同研究グループ
理化学研究所
環境資源科学研究センター
空間免疫制御理研ECL研究ユニット
理研ECL研究ユニットリーダー 佐藤 尚子(サトウ・ナオコ)
(開拓研究所 佐藤空間免疫制御理研ECL研究ユニット 理研ECL研究ユニットリーダー)
テクニカルスタッフⅠ 影山 友子 (カゲヤマ・トモコ)
粘膜システム研究チーム
リサーチアソーシエイト 長田 律(ナガタ・リツ)
専門技術員 加藤 完(カトウ・タモツ)
研究員(研究当時) 中西 由美子(ナカニシ・ユミコ)
テクニカルスタッフⅡ 橘 直子(タチバナ・ナオコ)
テクニカルスタッフⅡ 伊藤 鮎美(イトウ・アユミ)
チームディレクター 大野 博司(オオノ・ヒロシ)
脳神経科学研究センター
動物資源開発支援ユニット
技師 重野 佑布子(シゲノ・ユウコ)
辨野腸内フローラ研究所
理事長 辨野 義巳(ベンノ・ヨシミ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業国際共同研究加速基金(国際共同研究強化(A))(研究代表者:佐藤尚子、JP20KK0360)、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(研究代表者:佐藤尚子、21gm6310027h)、公益財団法人臨床薬理研究振興財団(研究代表者:佐藤尚子)による助成を受けて行われました。
原論文情報
- Naoko Satoh-Takayama, Yuko Shigeno, Ritsu Nagata, Tamotsu Kato, Yumiko Nakanishi, Tomoko Kageyama, Naoko Tachibana, Ayumi Ito, Yoshimi Benno, and Hiroshi Ohno, "Fibroblasts sense commensal-derived metabolites and regulate group 2 innate lymphoid cells-dependent defense in the stomach", Mucosal Immunology, 10.1016/j.mucimm.2026.01.007
発表者
理化学研究所
生命医科学研究センター 空間免疫制御理研ECL研究ユニット
理研ECL研究ユニットリーダー 佐藤 尚子(サトウ・ナオコ)
 佐藤 尚子
佐藤 尚子
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
