理化学研究所(理研)生命医科学研究センター 免疫転写制御研究チームの谷内 一郎 チームディレクター、徳島大学先端酵素学研究所 藤井節郎記念医科学センター 細胞情報学分野の小迫 英尊 教授、東京医科大学 免疫学分野の横須賀 忠 主任教授らの国際共同研究グループは、免疫細胞の一種であるT細胞[1]がどのタイプに分化するかを決める仕組みを明らかにしました。
本研究成果は、T細胞が胸腺[2]でCD4陽性ヘルパーT細胞[3]とCD8陽性キラーT細胞[4]という異なる系列に分かれる分子メカニズムの理解に新たな手掛かりを提供します。この知見は、免疫応答の理解を深めるものであり、今後の免疫学研究や関連技術の発展に寄与する可能性があります。
今回、国際共同研究グループは、転写因子[5]であるRunxタンパク質[6]の末端にある「チロシン」というアミノ酸のリン酸化[7]により、T細胞の分化の運命が決定されることを発見しました。
本研究は、科学雑誌『Nature Immunology』オンライン版(2月19日付:日本時間2月19日)に掲載されました。
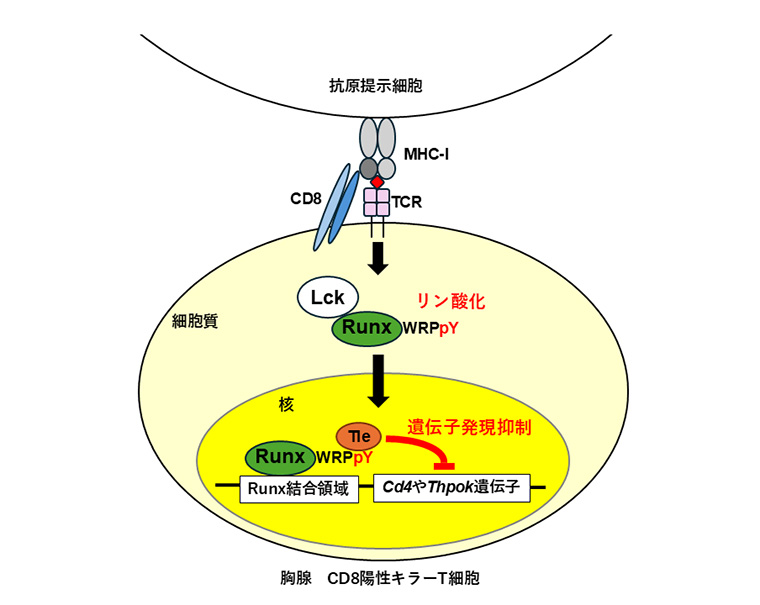
Runxタンパク質のリン酸化による胸腺T細胞の分化運命の制御
背景
私たちの体を守る免疫細胞の一種であるT細胞は、胸腺で発生し、最終的に以下の役割を持つ二つのタイプに分化します。
- (1)CD4陽性ヘルパーT細胞:免疫反応を助ける役割
- (2)CD8陽性キラーT細胞:ウイルス感染細胞や異常細胞を攻撃する役割
この分化は、T細胞が胸腺で受け取るシグナルによって決まります。T細胞は、T細胞受容体(TCR)[8]を介して胸腺上皮細胞が提示する抗原を認識します。抗原はMHC[9]という分子に結合した形で提示されますが、MHCは2種類あり、T細胞は認識したMHCのタイプによってそれぞれ別のタイプに分化します。
- (1)MHC-Iを認識したT細胞→CD8陽性キラーT細胞に分化
- (2)CD8陽性キラーT細胞:ウイルス感染細胞や異常細胞を攻撃する役割
T細胞が、この「どちらになるか」を決めるためには、T細胞受容体が感知したシグナルを核内の転写因子に伝え、系列特異的な遺伝子発現[10]を制御する必要があります。しかし、その分子機構は長年不明でした。
研究手法と成果
国際共同研究グループは、Runxタンパク質のカルボキシル末端(C末端)[11]に存在する進化的に保存されたアミノ酸配列「WRPY」に注目しました。この配列の最後にあるチロシン(Y)がリン酸化されることで、T細胞の分化に影響するのではないかと考えました。
そこで、RunxのC末端チロシン残基を、リン酸化状態を模倣するアミノ酸に置換した遺伝子改変マウス[12]を作製し、胸腺でのT細胞分化を解析しました。その結果、CD4陽性ヘルパーT細胞とCD8陽性キラーT細胞への分化に異常が見られ、チロシンのリン酸化が正常な分化に関与することが示唆されました。
さらに、ヒトT細胞株(Jurkat細胞[13])でRunxのリン酸化を解除すると、Runxと、転写因子や他の調節タンパク質に結合して遺伝子の発現を抑制する転写共抑制因子Tleの結合が阻害されることが分かりました。先行研究注1、2)では、RunxがC末端のWRPY配列を介してTleと結合し、CD4や転写因子ThPOKの発現を抑えることでCD8陽性キラーT細胞への分化を保証することが知られています。今回の結果は、RunxのC末端チロシン残基のリン酸化がRunxとTleの結合を制御し、T細胞分化の方向性を決定することを示唆しています。
さらに、胸腺で、CD8陽性キラーT細胞は、CD4陽性ヘルパーT細胞に比べてリン酸化されたRunxが多く、RunxとTleの結合も強いことが確認されました。また、Runxをリン酸化する酵素として、T細胞受容体シグナル伝達に関与するリン酸化酵素LckがRunxと結合し、リン酸化を担うことも明らかになりました。
最後に、MHC-I由来のシグナルがRunxのリン酸化に関係するかを調べたところ、MHC-Iを認識したCD8陽性細胞では、MHC-IIを認識した細胞よりもRunxとLckの結合が多いことが分かりました。これにより、MHC-IシグナルがRunxのリン酸化を促し、CD8陽性キラーT細胞への分化を制御することが示されました。
こうした結果から次のことが示唆されました。T細胞受容体を介したMHC-Iシグナルは、Lckなどのリン酸化酵素によってRunxのC末端チロシン残基のリン酸化を促進します。このリン酸化は、Runxと転写共抑制因子Tleの結合を制御するスイッチとして機能し、CD4およびThPOKの発現を抑えることで、CD8陽性キラーT細胞への分化を促進します。
- 注1)Setoguchi et al., Repression of the transcription factor Th-POK by Runx complexes in cytotoxic T cell development. 2008, Science, PMID: 18258917
- 注2)Taniuchi I. et al., Differential requirements for Runx proteins in CD4 repression and epigenetic silencing during T lymphocyte development. 2002, Cell, PMID: 12464175
今後の期待
本研究は、Runxタンパク質の末端チロシン残基のリン酸化がT細胞分化の運命を決める重要な仕組みであることを明らかにしました。今後は、このリン酸化を担う酵素や脱リン酸化酵素の詳細な解析、Runx–Tle複合体がどのようにゲノム上で働くかの解明が期待されます。これらの知見は、免疫応答の分子メカニズムをより深く理解するための重要な手掛かりとなります。
補足説明
- 1. T細胞
免疫応答を誘導するリンパ球の一群。他の免疫細胞を活性化したり、ウイルス感染した細胞を殺したりする機能を持つ。 - 2.胸腺
T細胞の分化に重要なリンパ組織の一つ。またT細胞が分化する際、自己タンパク質に応答する(自己応答性)Tリンパ球を選択して除去する機能を持つため、自己免疫疾患の発症を抑制する上でも重要な組織である。 - 3.CD4陽性ヘルパーT細胞
ヘルパーT細胞はリンパ球の一種で、さまざまなサイトカイン(細胞間の情報伝達を担うタンパク質の総称)の産生を誘導し、抗体を分泌するB細胞の活性化を促進する。CD4は、ヘルパーT細胞や樹状細胞などに発現している膜貫通糖タンパク質で、2種類あるMHC([9]参照)の中でII型MHC(MHC-II)に結合する。CD4陽性ヘルパーT細胞は、主にCD4陽性T細胞から分化し、産生するサイトカインによってTh1(IFN-γ)、Th2(IL-4)、Th17(IL-17)などに分類される。Th1はウイルス感染、Th2は寄生虫感染、Th17は真菌感染に対抗する免疫応答を起こす。 - 4.CD8陽性キラーT細胞
キラーT細胞はリンパ球の一種で、感染細胞やがん細胞を特異的に殺傷する。CD8は、T細胞受容体([8]参照)の共受容体として働く膜貫通糖タンパク質で、2種類あるMHC([9]参照)の中でI型MHC(MHC-I)に結合する。標的である感染細胞やがん細胞を抗原特異的に認識し、キラーT細胞が接着し、細胞傷害を誘導するタンパク質であるグランザイム(gzmB)やパーフォリン(pfr)などを放出して標的細胞を殺傷する。 - 5.転写因子
DNAに結合することで、遺伝子の発現を調節するタンパク質。 - 6.Runxタンパク質
転写因子の一種で、細胞の分化や増殖、アポトーシスなどの重要な生物学的プロセスを制御している。特に造血系や骨形成に関与しており、RunxファミリーにはRunx1、Runx2、Runx3の3種類がある。 - 7.リン酸化
タンパク質のリン酸化とは、タンパク質の特定のアミノ酸残基にリン酸基が付加される化学修飾。 - 8.T細胞受容体(TCR)
主にα鎖とβ鎖から成る膜貫通型タンパク質で、抗原を認識する。 - 9.MHC
MHCとは主要組織適合遺伝子複合体で、細胞表面に存在し、抗原ペプチドを提示することでT細胞に「自己抗原」や「異物(ウイルスや細菌など)」を知らせる仕組みを担う。I型MHC(MHC-I)とII型MHC(MHC-II)の2種類から成る。I型MHCはほぼ全ての細胞に発現し、細胞内の抗原を提示するのに対し、II型MHCはマクロファージ、樹状細胞、B細胞等に発現が限られており、細胞外の抗原を提示する。胸腺内でのT細胞初期分化課程では、I型MHCにより提示された抗原を認識できるTCRを発現するT細胞はキラーT細胞に分化し、II型MHCにより提示された抗原を認識できるTCRを発現するT細胞はヘルパーT細胞に分化する。MHCはmajor histocompatibility complexの略。 - 10.系列特異的な遺伝子発現
特定の細胞系列において、ある遺伝子の発現が他の系列と比べて選択的に促進または抑制される現象であり、細胞の分化や機能に重要な役割を果たす。 - 11.カルボキシル末端(C末端)
タンパク質の端に位置し、遊離のカルボキシル基(-COOH)を持つ側のこと。 - 12.遺伝子改変マウス
学術研究の実施を目的に人工的に遺伝子を改変したマウス。 - 13.Jurkat細胞
ヒト白血病T細胞由来の不死化T細胞株で、免疫学研究などで広く用いられている。
国際共同研究グループ
免疫転写制御研究チーム
チームディレクター 谷内 一郎 (タニウチ・イチロウ)
研究員 小川 ちひろ(オガワ・チヒロ)
上級研究員 奥山 一生 (オクヤマ・カズキ)
上級研究員(研究当時)香城 諭 (コウジョウ・サトシ)
上級研究員(研究当時)海老原 敬(エビハラ・タカシ)
研究員(研究当時)天野 麻理 (テンノ・マリ)
国際プログラム・アソシエイト シン・シシン(Qin Zhizhen)
テクニカルスタッフⅠ 室井 佐和子(ムロイ・サワコ)
構造バイオインフォマティクス研究チーム(研究当時)
チームリーダー(研究当時)ケム・ツァン(Kam Y. J. Zhang)
(現 制御分子設計研究チーム 上級研究員)
訪問研究員(研究当時)アディッティヤ・パディ(Aditya K. Padhi)
徳島大学先端酵素学研究所 藤井節郎記念医科学センター 細胞情報学分野
教授 小迫 英尊 (コサコ・ヒデタカ)
技術員 西野 耕平 (ニシノ・コウヘイ)
東京医科大学 免疫学分野
主任教授 横須賀 忠(ヨコスカ・タダシ)
講師 町山 裕亮 (マチヤマ・ヒロアキ)
長崎大学 大学院医歯薬学総合研究科 医療科学専攻 分子腫瘍生物学分野
教授 伊藤 公成 (イトウ・コウセイ)
愛媛大学 プロテオサイエンスセンター 無細胞生命科学部門
教授 澤崎 達也 (サワサキ・タツヤ)
准教授 高橋 宏隆 (タカハシ・ヒロタカ)
ハッケンサック大学医療センター(米国)Center for Discovery and Innovation
教授 ハイ-ホゥェイ・シュエ(Hai-Hui Xue)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業新学術領域研究(研究領域提案型)「血球系細胞分化過程での非ゲノム情報複製機構の解明(研究代表者:谷内一郎)」、同基盤研究(B)「C末端構造を介したRunx転写因子の機構制御機構の解明(研究代表者:谷内一郎)」、同基盤研究(C)「Runx転写因子分子間相互作用の網羅的解析(研究代表者:奥山一生)」、徳島大学先端酵素学研究所共同利用・共同研究拠点事業(研究代表者:谷内一郎、小川ちひろ)による助成を受けて行われました。
原論文情報
- Chihiro Ogawa, Kazuki Okuyama, Satoshi Kojo, Kohei Nishino, Hiroaki Machiyama, Aditya K. Padhi, Hirotaka Takahashi, Takashi Ebihara, Mari Tenno, Qin Zhizhen, Sawako Muroi, Kosei Ito, Tatsuya Sawasaki, Kam Y. J. Zhang, Hai-Hui Xue, Tadashi Yokosuka, Hidetaka Kosako and Ichiro Taniuchi, "Phosphorylation of Runx protein controls helper CD4+ T cell versus cytotoxic CD8+ T cell lineage choice", Nature Immunology, 10.1038/s41590-026-02441-6
発表者
理化学研究所
生命医科学研究センター 免疫転写制御研究チーム
チームディレクター 谷内 一郎 (タニウチ・イチロウ)
徳島大学先端酵素学研究所 藤井節郎記念医科学センター 細胞情報学分野
教授 小迫 英尊(コサコ・ヒデタカ)
東京医科大学 免疫学分野
主任教授 横須賀 忠 (ヨコスカ・タダシ)
 谷内 一郎
谷内 一郎
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
徳島大学先端酵素学研究所 事務室
Tel: 088-633-9420
Email: kousojimc@tokushima-u.ac.jp
東京医科大学 企画部 広報・社会連携推進室
Tel: 03-3351-6141(代表)
Email: d-koho@tokyo-med.ac.jp
