すべての生物は細胞からできており、細胞は生命の最小単位といえます。宮﨑 牧人 チームディレクターの研究チームは、一つ一つの細胞をいったんばらばらにし、必要と思われる最低限のパーツを組み合わせて細胞機能が再現される条件を探ることで、生命の仕組みの解明に取り組んでいます。この方法は構成論的手法と呼ばれ、2025年8月に発表した研究成果「「アクチン3Dプリンター」の開発」は、その手法による成果の積み重ねによるものです。
物理の手法を生物に応用
「小学生のころから生き物が好き、特にチョウが大好きでした」。チョウの中には、羽が緑に見えたり青に見えたりするものがいる。なぜ色が違って見えるのか。高校1年のとき、自分で採取したチョウの羽の鱗粉を電子顕微鏡を借りて観察したところ、一つ一つの鱗粉の形が違っていた。色の違いは色素によるものではなく、光の干渉によって起こることを知り、「自然界の事象が物理学で説明できる。物理ってすごい」と感じ、大学は物理学に進んだ。
物理学は、さまざまな現象の中から本質的な要素を抽出し、最終的に数式で現象を説明しようとする学問。要素を組み合わせて再現することが考え方の根底にあり、これこそが構成論的手法だ。大学4年のとき、生き物が好きだったこともあり生物物理学の道へ進み、大学院では、細胞内で化学エネルギーを使って運動を生み出す分子モーターを対象に研究した。このころから、構成論的手法で生物学にアプローチしたいと考えたという。
「例えば懐中時計の仕組みを理解するには、分解して必要な要素(部品)だけで組み立て直し、時を刻むための機能を再現する方法があります。同じようなことを生物でやろうと考えました」
「収縮環」を人工的に再現
構成論的手法で研究を始めたのは2011年。この手法による自身の最初の成果が出たのは2015年。動物細胞が分裂する際に細胞膜の直下に形成されるリング状の構造「収縮環」を人工細胞で再現した。収縮環の主な成分がアクチンとミオシンという2種類のタンパク質であることは既に分かっていた。しかし、どのようにして収縮環が形成されるのかは謎だった。そこで、必要最小限の要素でこの仕組みを再現しようと試みた。
アクチンとミオシン、両者を束ねるタンパク質、これら3種類のタンパク質を、さまざまな大きさの人工カプセルに入れた。その結果、20マイクロメートル(μm、1μmは1,000分の1mm )以下の人工カプセルのときだけ、収縮環ができて自然に収縮していく様子を観察できた。
「"包まれていること"が生命の定義の一つなのでカプセルで包んでみたのです。するとプレパラート上とは全く違う現象が起きました。この成功がなかったら今の自分はありません」。実際の細胞の大きさは10~20μmなので、これに近い大きさのときにだけ、カプセルの形に沿ってアクチンが集まり収縮環ができると考えられるという。
アクチンはすべての真核生物にあるタンパク質だ。細胞膜の直下に網目状のアクチンネットワークをつくり、細胞運動や細胞小器官の輸送に関わる細胞骨格として機能する(図1)。アクチン1分子は直径約5ナノメートル(nm、1nmは100万分の1mm)の小さな球に過ぎないが、集合してアクチンネットワークになると1,000倍もの大きさになる。しかし、頭脳もなく生命でもない分子が、どうやって巨大構造をつくるのかは不明な点が多い。
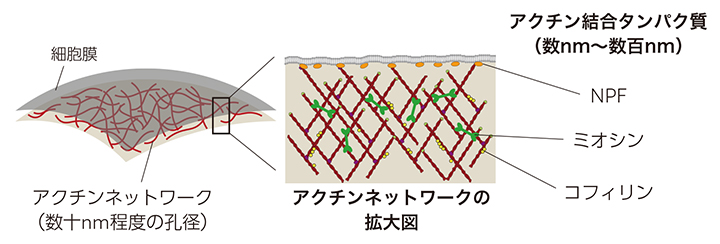
図1 細胞膜とアクチンネットワーク
そこで2022年、細胞骨格を人工の細胞膜上でつくることに挑んだ。「アクチンとネットワークの形成に必要なタンパク質を試験管内で混ぜても、細胞内で見られるようなきれいな構造はできません。アクチンの結びつきが最初に始まる細胞膜が重要なのではないかと考えたのです」。細胞と同じくらいの大きさ(一辺10umの正方形)の人工細胞膜をスライドガラスの上に格子状に並べ、必要なタンパク質を人工膜上に吸着させると、そこを起点にきれいな細胞骨格が組み上がった。
光遺伝学の技術で自由に操る
研究チームは実験ツールや実験装置を自作している。時間はかかるが、自作した方が研究対象のメカニズムを深く理解できるからだ。今回のアクチン3Dプリンターも実験ツールの一つだという。「細胞の中でのアクチンの動きを詳細に理解するために、自由にアクチンを操作できるツールが欲しかったのです」。人工細胞膜上に細胞骨格を形成する技術を発展させ、その形成を光で操作できるように工夫した。アクチンを素材に3次元構造を自在につくることができるので「3Dプリンター」というわけだ。
具体的にはアクチンを結びつけるNPFというタンパク質を、光遺伝学で使われる光応答性タンパク質と結合しやすいように作成し、人工膜に張り付けた。
図2が光照射によるアクチンネットワーク構築の仕組みだ。スライドガラス上に形成した人工脂質膜に光を照射すると、アクチン(赤)同士を結びつけるタンパク質NPF(黄)が脂質膜上に集積するように工夫した。光を照射する前はアクチンやNPFはタンパク質溶液中を漂っており、脂質膜上に張り付けた光応答性タンパク質(灰色)は活性化していない(図2A)。光を照射すると光応答性タンパク質は活性化し(青色に変化)、NPFが人工脂質膜上に集積し始め、アクチンネットワークの形成が始まる。光が弱いとNPFと光応答性タンパク質の結びつきが少なくネットワークの密度は低い(図2B)が、光が強いと密度が高くなる(図2C)。光の強度や照射範囲を自在に調節できるこの技術なら、柱状、薄いシートやリング、山型など、さまざまな形状の立体構造物をつくることが可能だ。
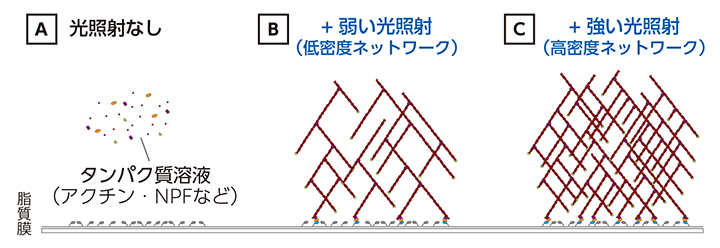
図2 光照射によるアクチンネットワークの構築
密度の違いがタンパク質の機能を調節?
続いて、アクチン3Dプリンターを使って、アクチンネットワークの密度の違いが、力を生み出すモーター分子であるミオシンや、アクチンを分解するタンパク質のコフィリンと、どう関係しているかを調べた。
その結果、アクチンネットワークの密度がある値より高くなると、ミオシンはネットワークに入り込めなくなった(図3A)。ミオシンのサイズが大きいことが関係していると考えられる。その一方、ミオシンはアクチンと結びつきやすい性質を持つため、密度がある値より低い場合は、アクチンネットワークの密度の高い方がアクチンと結びつきやすくなるので、より多くのミオシンが集まることになる。実験では、ミオシンはアクチン密度の高い方に集まり、その生み出す力によってアクチンネットワーク自体が密度の低い方から高い方に向かって移動することを人工膜上で確認した(図3B)。これは、実際の生きた細胞でも、アクチンネットワークの移動の方向が密度の違いによって決められることを示唆している。
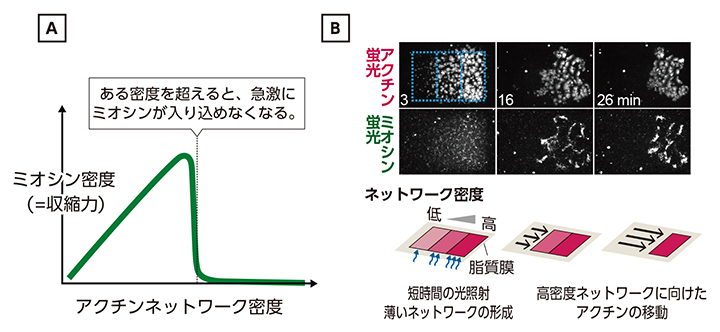
図3 アクチンネットワークの密度の違いでアクチンが動く
一方、コフィリンは小さいため密度に関係なくネットワークに入り込めるが、高密度のネットワークではコフィリンによるアクチンの分解が抑制されていた。
「アクチンネットワークの密度は、細胞骨格に関わるタンパク質の機能まで調節する可能性が示されました。ただ、なぜ、コフィリンは高密度ではアクチンを分解しないのか。それはまだ分かりません。ネットワークの再現には成功しましたが、また謎な点が出てくる。だから面白いのです」

図4 顕微鏡で観察するための試料(サンプル)作成
青みのある光では試料の反応が進んでしまうため、黄色い光の下で作業する。
関連リンク
- 2025年8月26日プレスリリース「「アクチン3Dプリンター」の開発」
- 2024年1月31日プレスリリース「さまざまな形やサイズの細胞骨格を人工生体膜上で作る」
この記事の評価を5段階でご回答ください

